研究 (Research)
最終更新日:
非コードRNAによる細胞内構造構築機能の研究 (Study of intracellular architecture by noncoding RNAs)
教授 廣瀬 哲郎(生命機能研究科) HIROSE Tetsuro(Graduate School of Frontier Biosciences)
研究の概要
ヒトゲノムが産生する数万種類もの非コードRNAの中には、細胞内構造体の骨格として働くものがある。RNAがいかにして巨大な構造体を形成するかについて、ソフトマター物理学理論と実験検証によって、RNA-タンパク質複合体によるミセル化が構造構築の鍵となることを突き止めた。一方で、非コードRNAを骨格とした構造体が細胞内でどのように働いているかを解析し、非コードRNAのメチル化を介したスポンジ機能によって熱ストレス応答に関わる遺伝子発現を制御していることを明らかにした。
研究の背景と結果
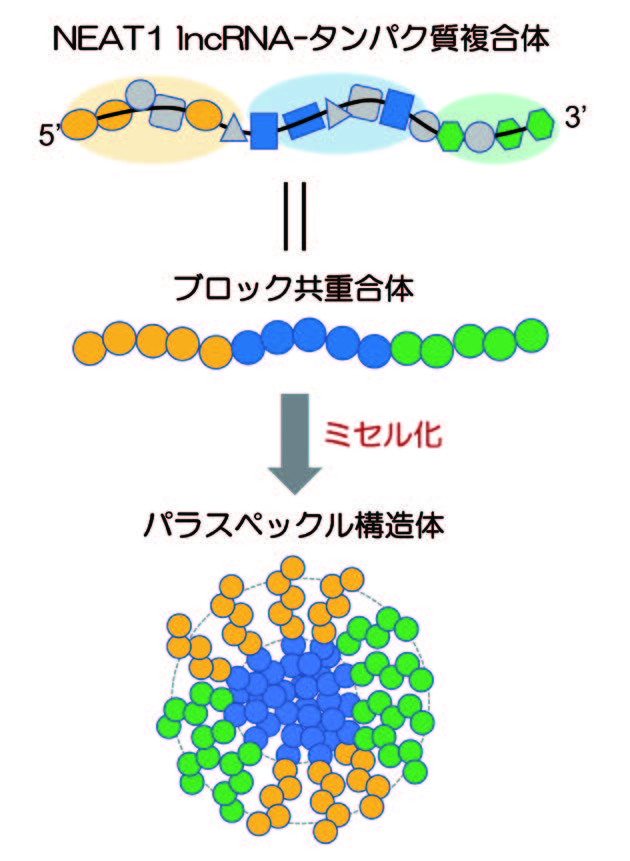
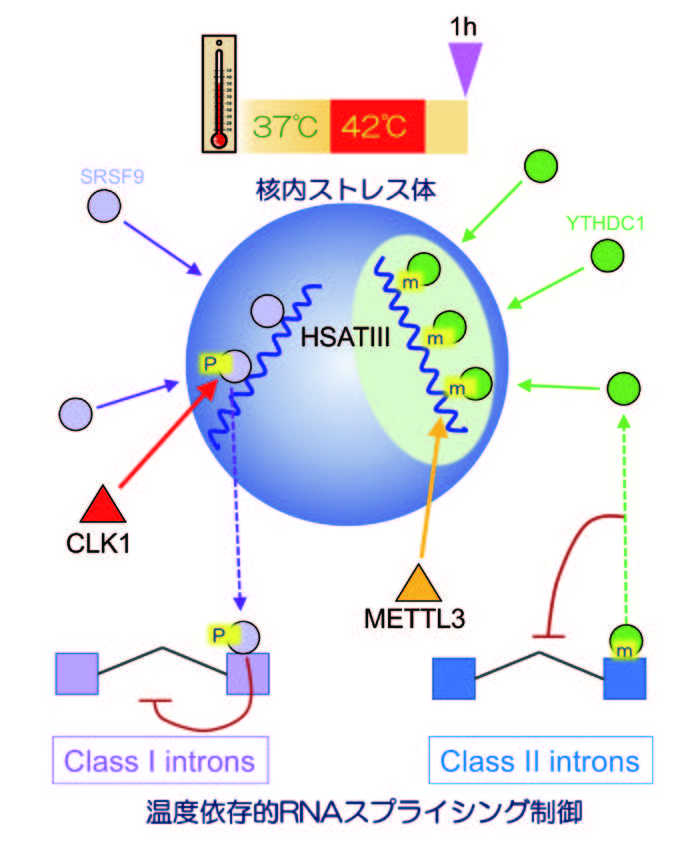
21世紀初頭のヒトゲノム配列解読でヒトゲノムの2%にしかタンパク質情報がコードされていないことが明らかになった。その後、ゲノムの大部分を占める非コード領域から多数の非コードRNAが合成されていることが明らかになり、「ゲノムの暗黒物質」としてその機能に大きな注目が集まった。我々は、その中から細胞内構造の骨格として働く非コードRNAを世界で初めて発見した。その一方で、細胞内相分離現象が細胞生物学分野で大きな注目が集めるようになった。相分離現象は、混み合った細胞内環境に隔離した空間を一過的に形成する機構として、細胞空間の区画化の一般的機構と考えらる。細胞内相分離は、安定な構造を取らない天然変性タンパク質やRNAのような生体高分子によって誘発される。上述の我々が発見した非コードRNAよる構造体形成も相分離によることが明らかになり、さらに非コードRNAが相分離を誘発することが明らかになった。今回の研究では、非コードRNAが相分離構造体を形成する機構を、ソフトマター物理学理論とその検証実験で明らかにし、核内構造体パラスペックルがRNA-タンパク質複合体のミセル化によって形成されることが明らかにした(図1)。これによって、理論に基づいてRNAによる相分離体を設計する道筋が開けた。一方で、相分離構造体が細胞内でどのような役割を果たしているかを解析し、熱ストレス誘導性の非コードRNAが形成する核内ストレス体が、非コードRNA自身のメチル化修飾を介して制御因子を繋留する「分子スポンジ」として、温度依存的な遺伝子発現を制御することを見出した。以前我々が報告したタンパク質リン酸化反応の「るつぼ」としての機能と併せて、核内ストレス体は、「スポンジ」「るつぼ」という独立した2つの作用機構によって温度依存的な遺伝子発現を広くコントロールしていることが明らかになり(図2)、これによって非コードRNAが細胞内相分離を誘発して構造体を形成する意義を明確に示すことができた。
研究の意義と将来展望
ポストゲノム時代に現れた非コードRNAの中には、相分離を誘発して細胞内構造体を形成するものが存在する。本研究では、RNAによる相分離誘導が、世界中で研究されているタンパク質による典型的な液-液相分離とは異なるミセル化によることを示し、非コードRNAによる構造体内部構造の形成機構を明らかにした点で相分離研究の基盤となる先駆的成果と言える。一方で、細胞内での相分離構造体の作用機構について、RNAメチル化を介したスポンジ機構による温度依存的な遺伝子発現制御機構を明らかにした。この成果は細胞内相分離の意義を示した点で意義深い。これらの成果は今後の細胞内相分離の分子機構や生体機能の理解のための基盤知見となりうる。
担当研究者
教授 廣瀬 哲郎(生命機能研究科)
キーワード
非コードRNA/遺伝子発現/細胞内構造/相分離/ストレス応答
応用分野
医療・ヘルスケア/創薬
参考URL
https://resou.osaka-u.ac.jp/ja/research/2021/20210422_1
https://resou.osaka-u.ac.jp/ja/research/2021/20210629_1
