研究 (Research)
最終更新日:
ピロリ菌代謝産物が誘導する胃炎発症機構 (Pathogenic metabolites in Helicobacter pylori that exacerbate gastritis)
教授 山崎 晶(微生物病研究所 分子免疫制御分野・免疫学フロンティア研究センター 分子免疫学) YAMASAKI Sho(Research Institute for Microbial Diseases / Immunology Frontier Research Center)
研究の概要
本研究では、ヘリコバクター・ピロリ(ピロリ菌)、が胃炎を引き起こすメカニズムを明らかにした。ピロリ菌は、宿主のコレステロールを取り込んだ後、菌内で糖と脂質を付加することで、胃炎を誘導する化合物を生成する。これらの化合物を、宿主受容体のMincleとDCARが認識し、胃炎が発症することを新たに見出した。またこの修飾経路を阻害することで、ピロリ菌による胃炎を防ぐことも見出した。
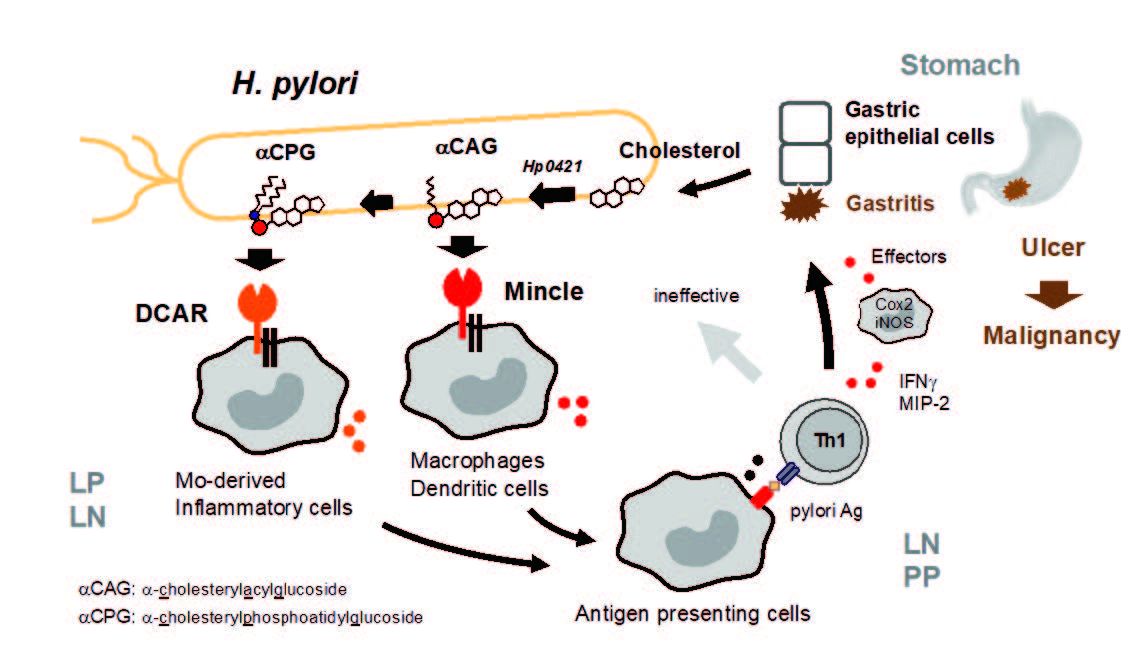
研究の背景と結果
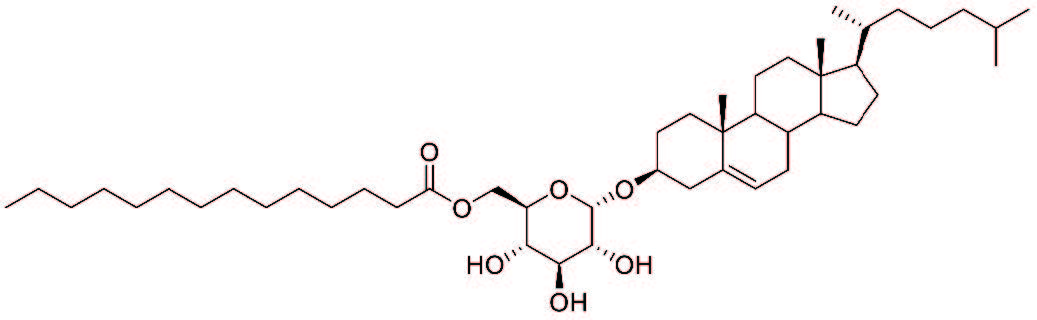
世界人口の約半数が、慢性胃炎、胃癌発症の原因とされるピロリ菌に感染している。ピロリ菌は宿主の免疫系を過剰に活性化することで胃炎を引き起こすと考えられていたが、免疫系を活性化するメカニズムに関しては不明だった。本研究では、ピロリ菌から抽出した脂質成分の中から、宿主(マウス)の炎症性サイトカイン産生を誘導する物質を同定し、さらにその物質がMincleと呼ばれる宿主の自然免疫受容体に認識されることを見出した。同定された物質α-コレステリルグルコシド(αCAG)は、ピロリ菌が持つ酵素によって宿主のコレステロールが修飾され産生された糖脂質である。αCAGの受容体であるMincleの遺伝子を欠損させたマウスにピロリ菌を感染させたところ、野生型のマウスに感染させた場合と比べ、体内の菌体数には差は認められなかったにもかかわらず、免疫細胞の活性化が抑制され、胃炎が軽減することが分かった。さらに、αCAGと構造が類似するα-コレステリルホスファチジルグルコシド(αCPG)も、DCARと呼ばれる自然免疫受容体に認識され、宿主の免疫系を活性化することを見出した。次に、αCAGとαCPGの合成に必要な酵素コレステリルグルコシルトランスフェラーゼ(Hp0421)の遺伝子を欠損させたピロリ菌を作出した。このピロリ菌を感染させたマウスでは、野生型のピロリ菌を感染させた場合と比較して菌数は変わらないものの、胃炎は軽減していた。以上の結果より、ピロリ菌が生成するαCAG/αCPGという免疫賦活化物質が宿主の免疫細胞が活性化され胃炎が引き起こされることが明らかなった。Hp0421はピロリ菌が属するヘリコバクター属に特有の酵素であるため、治療標的としての特異性が高く、安全性も高い。この治療法は、ピロリ菌が引き起こす炎症反応を抑制するもので、除菌とは全く異なるコンセプトであり、ピロリ菌が宿主に悪さをしないようにさせれば、除菌ではなく“共存”という治療も選択できることを示唆した。
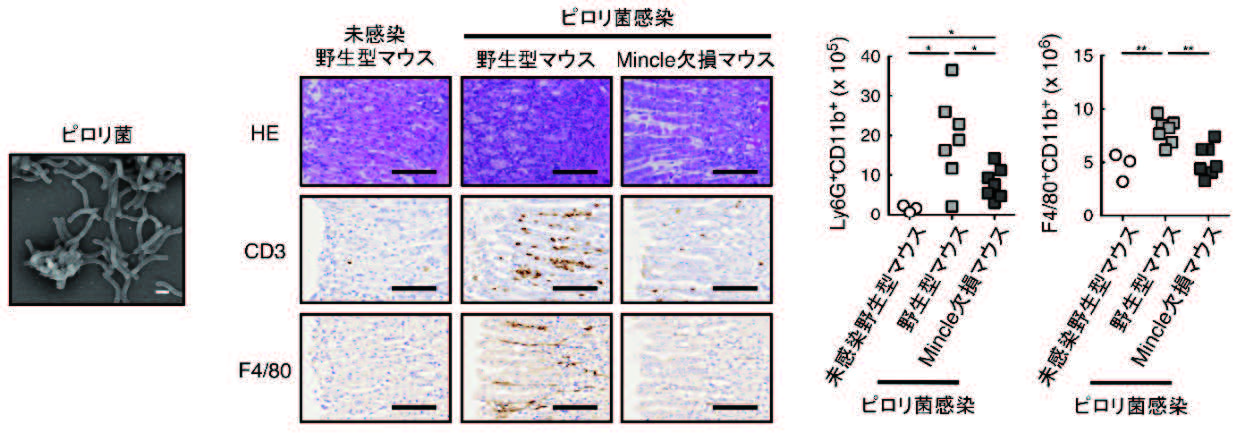
研究の意義と将来展望
慢性胃炎、胃癌発症の原因とされるピロリ菌。世界人口の約半数が感染しているとされる。国内では現在も6000万人近くの感染者がいると推定されている。通常は、抗菌薬と胃酸分泌抑制剤を内服することでピロリ菌を除菌できる。しかし、2回の除菌を行っても治療がうまくいかないケース、抗菌薬による細菌叢バランスの破綻などが課題となっている。ピロリ菌は宿主の免疫系を過剰に活性化することで胃炎を引き起こしていると考えられている。しかし、ピロリ菌の菌体表面は、マクロファージや樹状細胞が持つ自然免疫受容体が認識できない構造を有しており、ピロリ菌がどのように宿主の免疫系を活性化しているか不明だった。今回の研究の意義は、抗菌薬を使うことなく、ピロリ菌を宿主体内で“共存”させ、ピロリ菌による胃炎を抑制させる、新規治療コンセプトを提案するものである。
担当研究者
教授 山崎 晶(微生物病研究所 分子免疫制御分野・免疫学フロンティア研究センター 分子免疫学)
キーワード
慢性胃炎/ヘリコバクター・ピロリ/C型レクチン受容体/コレステリルグルコシルトランスフェラーゼ
応用分野
医療/創薬
参考URL
https://resou.osaka-u.ac.jp/ja/research/2020/20200929_4
http://www.biken.osaka-u.ac.jp/achievement/research/2020/146
https://medical.nikkeibp.co.jp/leaf/mem/pub/report/202012/568092.html? pr=1
