研究 (Research)
最終更新日:
新規機能性ペプチドの酵素的合成につながる翻訳後修飾酵素の構造と反応機構 (Structures and reaction mechanisms of posttranslational modification enzymes targeting biosynthesis of novel functional peptides)
准教授 岡島 俊英(産業科学研究所 生体分子反応科学研究分野) OKAJIMA Toshihide(SANKEN (The Institute of Scientific and Industrial Research))
研究の概要
遺伝子から翻訳されたタンパク質やペプチドの多くは、特異的な酵素による化学修飾を通じて機能の発現とその制御が可能となります。我々はこのようなタンパク質の飜訳後修飾反応に注目し、その修飾酵素の反応機構を生化学的・構造生物学的な手法を組み合わせて解明しています。タンパク質・ペプチドの修飾酵素は、ペプチドの環状化やキノン形成などを特異的に行うことが可能であり、我々は新しい創薬の基盤や機能性ペプチドを作り出すためのツールとして応用することを目指しています。
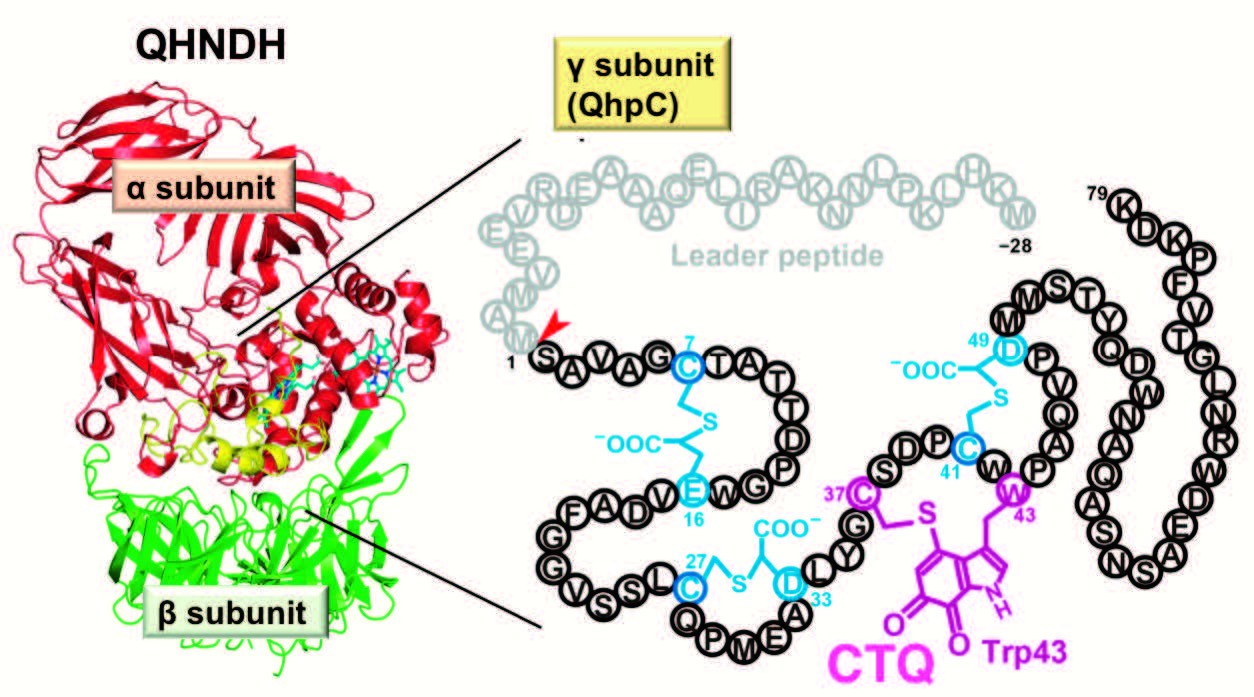
研究の背景と結果
遺伝子から飜訳されたタンパク質やペプチドは、特異的な化学修飾、すなわち飜訳後修飾を受けることによって、機能を発現し、あるいはその機能が制御されることが知られています。我々は、多くの細菌に存在するキノヘムプロテインアミン脱水素酵素の2つの特異な飜訳後修飾に注目しています。いずれも小さな酵素サブユニットQhpCに存在しており、1つは、3ヶ所の分子内チオエーテル架橋構造であり、もう1つがアミノ酸残基に由来する補酵素、システイントリプトフィルキノン(CTQ)です。後者は酵素触媒反応の反応中心であり、トリプトファン残基がキノン化されるとともに、QhpCに4つめの架橋構造を形成しています。複雑な構造から、QhpCは多段階の翻訳後修飾によって作り出されていることが考えられ、その機構が注目されてきました。これまでの我々の研究によると、QhpCは、成熟型にはない28残基のN末端リーダーペプチドを含んだ前駆体として翻訳され、まずラジカル酵素QhpDおよびフラビン酵素QhpGと3者複合体を形成します。その中でQhpDの作用によって、3つの分子内チオエーテル架橋がQhpCに形成されます。さらに連続して、複合体中でQhpGが補酵素前駆体のトリプトファン残基側鎖に2つの水酸基を導入することがわかりました。リーダーペプチドがプロテアーゼによって除去されたのち、修飾QhpCは細菌のペリプラズムに輸送され、そこでCTQ形成が完結すると考えられました。このうち、QhpGに関しては、最近、結晶構造が決定され、触媒反応やQhpCとの相互作用の詳細が解明されました。タンパク質中のトリプトファン残基を特異的に二水酸化する酵素は、これまでに報告のない新規なものでした。QhpCの多段階の翻訳後修飾の反応は、最終ステップを除いて試験管内で再現可能であり、その全メカニズムの解明に向けて研究を進めています。
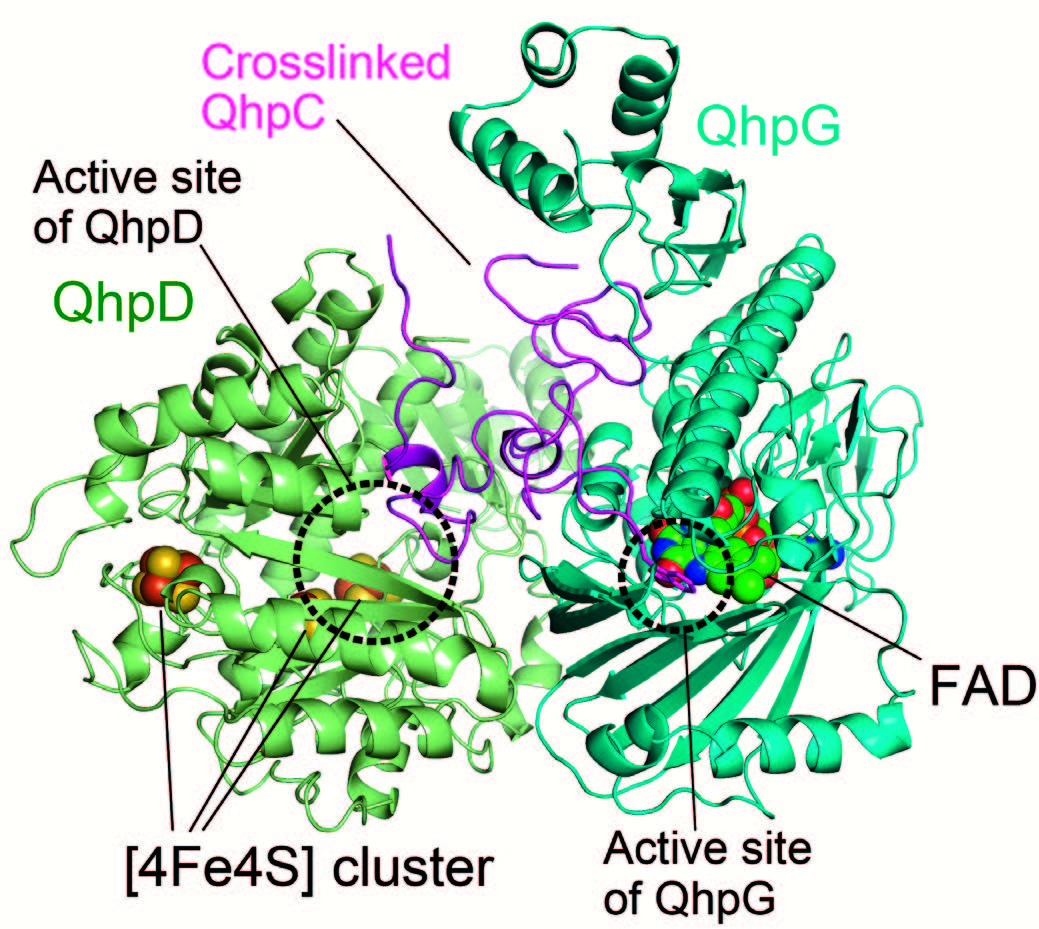
研究の意義と将来展望
近年、環状化ペプチドをベースとした中分子サイズの化合物は、高い親和性を維持しつつ、低分子化合物の扱いやすさと膜透過性をあわせもつ次世代型創薬の基盤として注目されています。本研究で示されるようなタンパク質・ペプチドの翻訳後修飾酵素は、新しい創薬の基盤や機能性ペプチドを作り出すためのツールとして活用されることが期待されます。また、このような酵素反応をベースとした化合物合成は、基本的に常温常圧で実行可能であり、有機溶媒を必要とせず、環境負荷の少ないグリーンケミストリーのコンセプトにも合致しています。
担当研究者
准教授 岡島 俊英(産業科学研究所 生体分子反応科学研究分野)
キーワード
翻訳後修飾、環状化ペプチド/補酵素/チオエーテル結合
応用分野
医療・ヘルスケア/創薬
