研究 (Research)
最終更新日:
ワクチン開発に資する免疫記憶成立メカニズムの解明 (Mechanism for the establishment of immunological memory)
特任准教授(常任) 井上 毅(免疫学フロンティア研究センター 分化制御) INOUE Takeshi (Immunology Frontier Research Center)
研究の概要
新型コロナウイルスやインフルエンザウイルス感染に対する生体防御メカニズムの解明は社会的にも重要かつ喫緊の課題である。ワクチン開発はこれら感染症予防に必須の戦略であるが、ワクチン療法の基本原理である免疫記憶の中心を担う記憶B細胞が産生されるメカニズムは不明な点が多く残されている。我々は、免疫応答時にB細胞分化・選択の場としてはたらく2次リンパ組織中の胚中心に着目し、胚中心において記憶B細胞への分化運命決定がなされてすぐの記憶B 前駆細胞を同定した。この前駆細胞の性質・機能を解析したところ、より代謝活性の低く、かつB細胞受容体からの生存シグナルをより多く獲得した細胞群が記憶B細胞に効率的に分化することを明らかにした。
研究の背景と結果
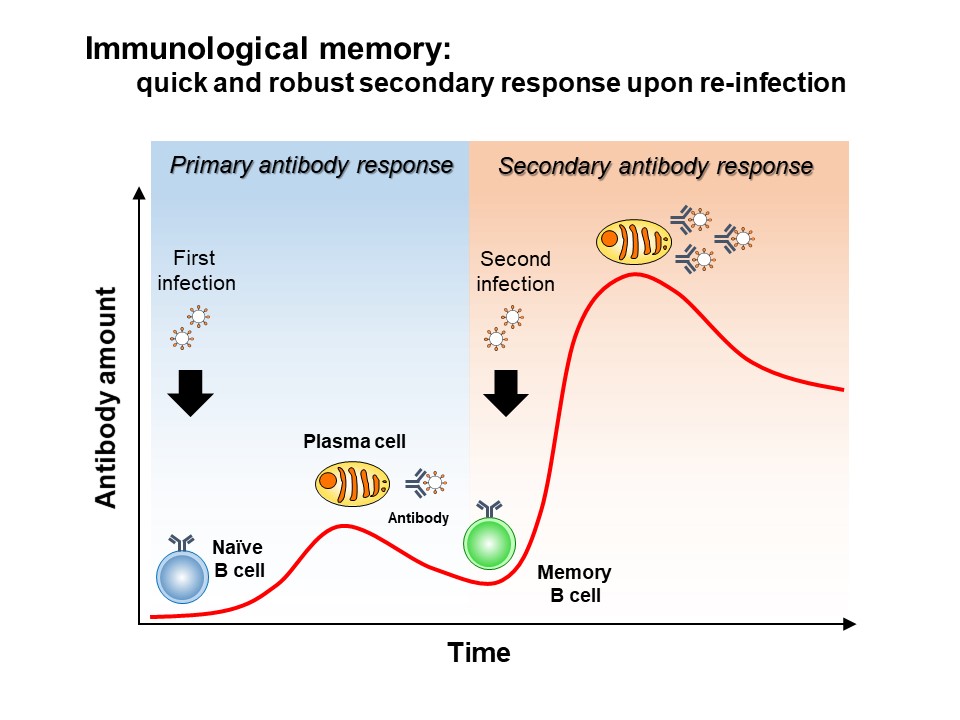
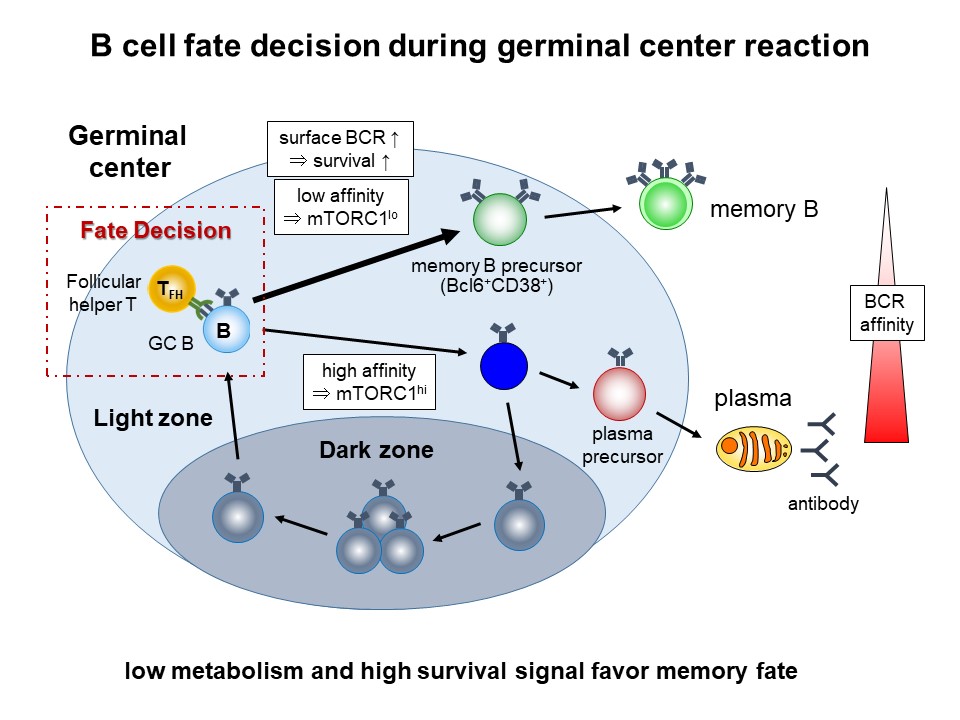
細菌・ウイルスなどの病原体の2度目の侵入時に迅速に反応して抗原を除去する仕組みが「免疫記憶」である。これは1度目の感染時に作られた記憶B細胞が記憶T 細胞の助けをかりて素早く抗体産生細胞に分化し、効果的に抗原をブロック・除去する能力による(図1)。高親和性の記憶B細胞は主に2次リンパ組織の中で胚中心から産生されるが、胚中心B細胞にはそのほかにも、抗体産生細胞に分化するもの、胚中心に留まるものが共存しており、どのように分化の運命選択がなされているのか、そのメカニズムの詳細は不明であった。我々は、胚中心には記憶B細胞へ分化することが決定された記憶B細胞の前駆細胞が存在すると考え、胚中心B細胞の特徴を保ちつつも記憶B細胞の性質を獲得しはじめている細胞の同定を試みた。その結果、胚中心B細胞の機能に必須の転写因子Bcl6と、記憶B細胞のマーカーであるCD38の両方を発現する稀少細胞集団を発見し、遺伝子発現の解析や細胞機能の解析などからこれが胚中心B細胞と記憶B細胞の中間状態の細胞( =記憶B 前駆細胞) であることを示した。この細胞の性質を詳細に解析したところ、抗体産生細胞に分化する細胞や胚中心に留まる細胞と比較して、細胞の代謝制御を司るmTORC1タンパク質の活性が低いことを見出した。そこで、免疫応答時にB細胞のみでmTORC1活性を阻害することのできる実験系を開発し、胚中心B細胞の分化を解析したところ、mTORC1活性を低減させたB細胞は記憶B細胞への分化が亢進することが分かった。さらに我々は、記憶B 前駆細胞は胚中心B細胞と比較して細胞表面のB細胞受容体の発現量が高く、その結果細胞の生存因子の一つであるBcl2の発現が上昇していることも見出した。本研究の結果から、低親和性B細胞はT 細胞ヘルプを少ししか受け取れないためmTORC1活性は低く保たれるいっぽう、B細胞受容体の発現が高くなることでより細胞の生存に有利にはたらいていることが分かり、この2つのメカニズムが、休止状態で長寿命である記憶B細胞へ分化するために重要な役割を果たしていることが明らかとなった(図2)。
研究の意義と将来展望
HIV やインフルエンザウイルス感染においては、胚中心B細胞が抗体遺伝子に再度変異を獲得し、適切な抗原親和性を持つ抗体を発現する能力を記憶B細胞として保持していくことで変異ウイルスに対する生体防御能が発揮されると考えられている。我々の研究による記憶B細胞分化メカニズムの解明は、例えば現行のインフルエンザワクチンではなぜ変異ウイルスに対する有効な記憶B細胞を誘導できず、毎年のワクチン接種が強いられるのか、といった問いに答え、革新的なワクチン開発のための基盤的データを提供するものと期待される。
担当研究者
特任准教授(常任) 井上 毅(免疫学フロンティア研究センター 分化制御)
※本学ResOUのホームページ「究みのStoryZ」に、インタビュー記事が掲載されています。是非ご覧ください。
https://resou.osaka-u.ac.jp/ja/story/2019/icfbo5/
キーワード
B細胞/抗体/ワクチン/免疫記憶
応用分野
医療・ヘルスケア
参考URL
http://llymph.ifrec.osaka-u.ac.jp/index.html
https://resou.osaka-u.ac.jp/ja/story/2019/icfbo5
