研究 (Research)
最終更新日:
がん原因遺伝子 ELF3 の新たな機能の解明と新規薬剤の開発 (Targeting ELF3-dependent transcription for cancer therapeutics)
助教 鈴木 雅美、教授 谷内田 真一(医学系研究科 がんゲノム情報学) SUZUKI Masami , YACHIDA Shinichi(Graduate School of Medicine)
研究の概要
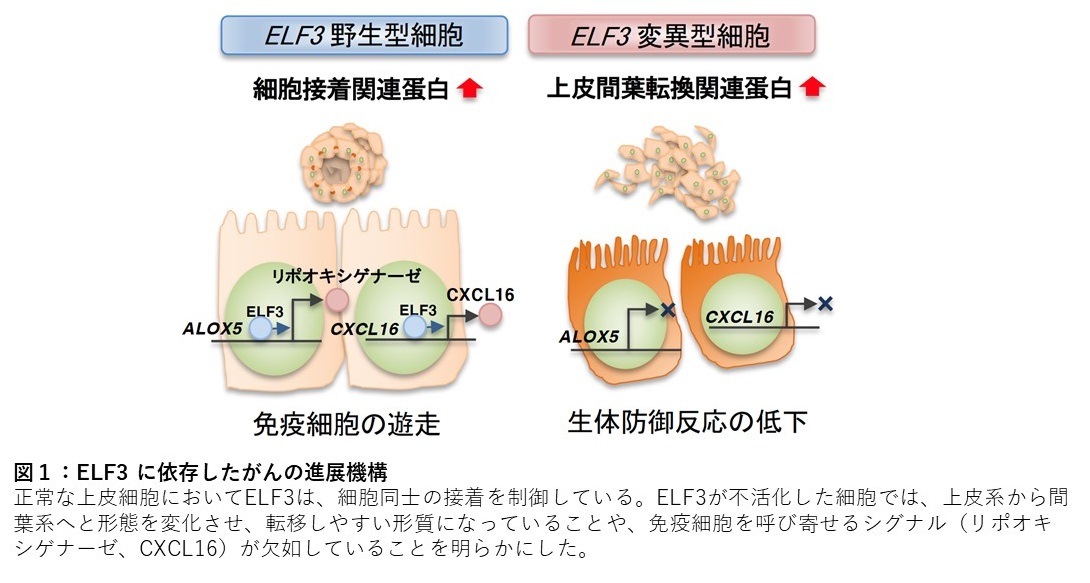
ELF3(E74 Like ETS transcription Factor 3) は、正常な上皮組織の維持に重要な役割を担う転写因子である。我々はこれまでに、十二指腸乳頭部がんを用いたゲノム解析から ELF3 の不活化変異を見出し、ELF3は新たな“がん抑制遺伝子” であることを報告した。さらにゲノム編集技術によりELF3の発現を調節した胆管上皮細胞株を用いて、ELF3が直接的にその発現を制御する遺伝子として、がんの転移に関与する転写因子や細胞接着分子、免疫細胞を調節する蛋白などを特定し、ELF3の機能低下は細胞の転移/ 浸潤を増大させることを明らかにした(図1)。
研究の背景と結果
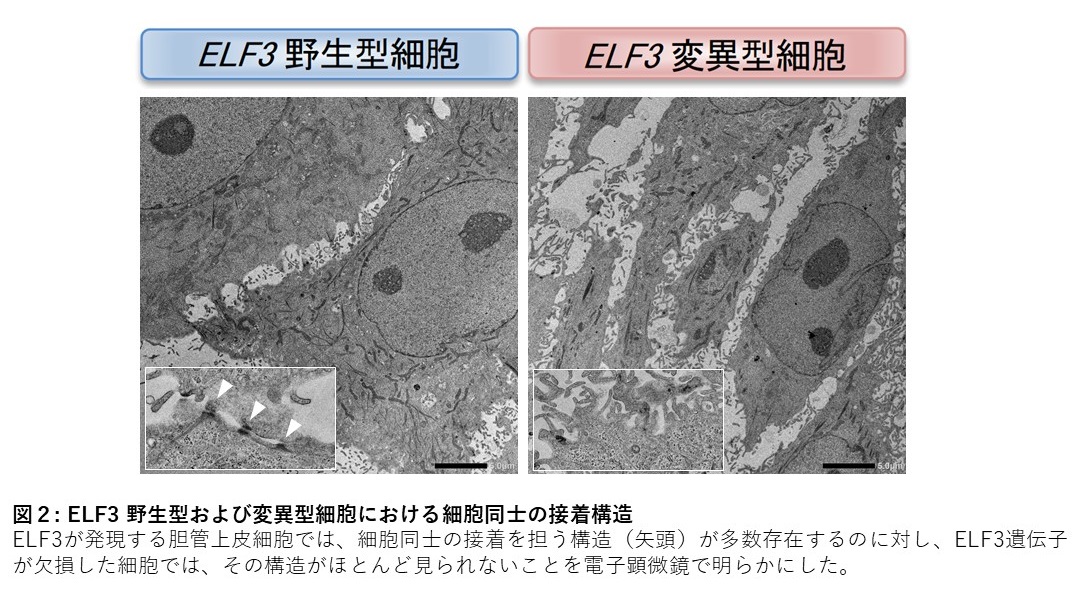
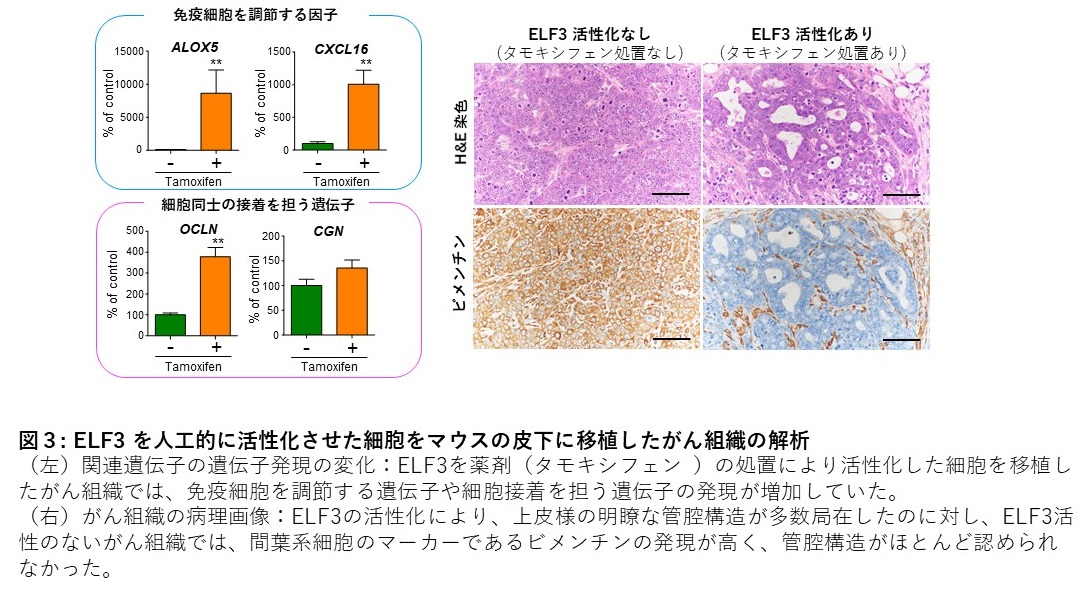
我々の研究グループは、十二指腸乳頭部がんの大規模ゲノム解析によりELF3の不活化変異を見出し、正常な上皮組織の維持を担うELF3が新たな“がん抑制遺伝子” であることを報告した。一方、肺がんや大腸がんにおいて、ELF3はがん進展に寄与する“がん遺伝子” としても報告されており、臓器や細胞の種類に依存して、がんを抑制する機能と促進させる機能の両方を持つことが分かってきた。このようにELF3は二面性を有しているものの、転写因子としてどのような遺伝子発現を制御してがんの進展に関わるかについては明らかにされていない。本研究では、ゲノム編集技術によりELF3の発現を調節した胆管上皮細胞を用いて網羅的な遺伝子発現解析とクロマチン免疫沈降シーケンス解析を行い、ELF3が直接的に転写を制御する遺伝子の探索を行った。これらの解析から、ELF3のターゲット遺伝子として、上皮間葉転換を担う転写因子である ZEB2および細胞接着に関連する蛋白であるcingulin を同定し、ELF3の機能が低下した胆管上皮細胞では、細胞同士の接着を担う構造が乏しいことを電子顕微鏡レベルでも明らかにした( 図2)。またELF3の発現がない細胞では、細胞の浸潤する能力が高く、がんが転移しやすい細胞に形質変化することを示した。さらにELF3が免疫細胞を組織に呼び寄せるリポオキシゲナーゼやCXCL16の発現制御を担うことも明らかにした。実際に、ELF3を高発現させた細胞では、これらの発現が増加し、細胞障害性の免疫細胞を呼び寄せる能力が高いことがわかった。さらにこの細胞に既知のがん原因遺伝子とELF3の活性化をタモキシフェンにより調節することができる融合蛋白質を導入し、マウスの皮下に移植したがん組織を解析すると、ELF3が活性化したがん組織では、リポオキシゲナーゼやCXCL16の発現が増加していることに加えて、細胞接着を担う蛋白の発現に伴って多数の管腔様構造を形成していることが明らかとなった ( 図3)。一方、ELF3を活性化させていないがん組織では、管腔様構造はほとんど認められず、間葉系細胞のマーカーであるvimentin の発現が高かった。これは、ELF3の活性化がないがん組織は、転移・浸潤しやすいことを示唆している( 図3)。
研究の意義と将来展望
ELF3の遺伝子異常は、日本人に多い胆道系のがんに多く見られる。新たな“がん抑制遺伝子” として見出したELF3は、最近では難治性がんにおいて遺伝子増幅を起こしており、スーパーエンハンサーを形成してがんの進展を促していることも明らかにされつつある。近年、がん原因遺伝子の異常に基づく最適な治療薬の提供、いわゆる「がんゲノム医療」が実現している。がん原因遺伝子は出尽くした様に思われていた矢先に、ELF3は新規ドライバー遺伝子として同定された。ELF3のがん進展に関わる機能を明らかにすることで、複雑で多様な難治性がんの本態を解明し、がんゲノム医療を見据えた新規薬剤の開発に繋げたいと考えている。
担当研究者
助教 鈴木 雅美、教授 谷内田 真一(医学系研究科 がんゲノム情報学)
キーワード
ELF3/転写因子/がん
応用分野
医療・ヘルスケア/創薬
