研究 (Research)
最終更新日:
基底膜への細胞接着の分子基盤の解明 (Elucidation of the molecular basis of cell adhesion to the basement membrane)
教授 高木 淳一、准教授 有森 貴夫(蛋白質研究所 蛋白質化学研究部門) TAKAGI Junichi , ARIMORI Takao(Institute for Protein Research)
研究の概要
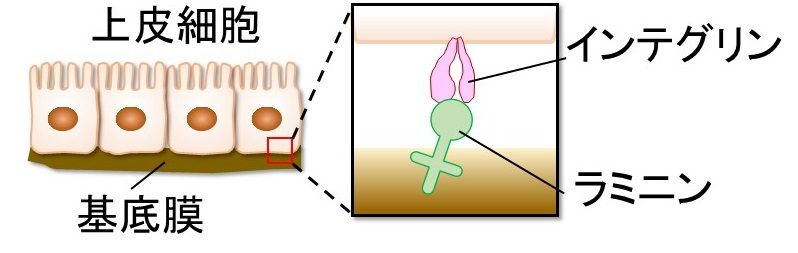
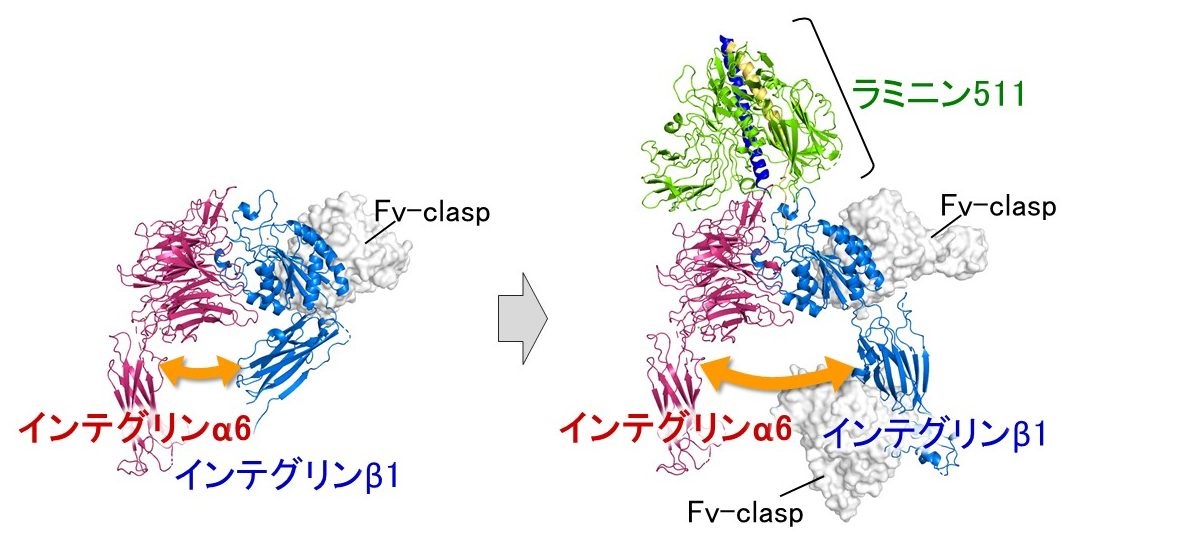
ラミニンは基底膜の主要な構成分子の一つであり、細胞表面の受容体であるインテグリンに結合することで、上皮細胞を基底膜に接着させ、細胞内に情報を伝える(図1)。この両者の結合は、胚発生、臓器の形成や恒常性維持などに関わる非常に重要な分子間相互作用である。我々は、Fv-clasp という独自の技術を応用することで、インテグリンα6β1およびインテグリンα6β1- ラミニン511複合体の立体構造を、それぞれX 線結晶構造解析およびクライオ電子顕微鏡単粒子解析により決定することに成功した(図2)。これらの構造から、インテグリンがどのようにラミニンを認識し、その結果どのように細胞内へと情報を伝達するのかが明らかになった。
研究の背景と結果
生体内の様々な臓器の表面は、基底膜というシート状の構造体の上に接着した上皮細胞により構成されており、各臓器が正常に機能する上で、基底膜への細胞接着とそれに伴う情報伝達は必須のプロセスである。この細胞接着において中心的な役割を担っているのが、基底膜の主要な構成分子であるラミニンと、その受容体であるインテグリンである。しかし、ラミニンもインテグリンも巨大でフレキシブルな分子であるため構造解析が難しく、両者の認識機構の詳細は明らかになっていなかった。構造解析を容易にするツールとして、しばしばFab や単鎖Fv といった小型抗体が利用される。これは、小型抗体の結合により標的分子の構造の安定化などが期待できるためである。しかし、従来の小型抗体では生産性の悪さや構造の剛性の低さなどが問題となることがあった。そこで我々は以前、これらの問題を克服した“Fv-clasp” という新規の小型抗体フォーマットを開発した。本研究では、このFv-clasp を応用することでラミニン/ インテグリンについて重要な構造情報の取得に成功した。まず、代表的なラミニン受容体であるインテグリンα6β1の結晶化においては、Fv-clasp を結合させたことで初めて結晶が得られ、構造が決定できた(図2、左)。さらに、インテグリンα6β1とリガンドであるラミニン511の複合体においても、Fv-clasp を結合させることで非常に安定な複合体試料が得られ、クライオ電子顕微鏡単粒子解析による構造決定に成功した(図2、右)。得られた立体構造から、ラミニンの結合に伴い生じるインテグリンのダイナミックな構造変化と、その構造変化の引き金となるラミニンγ鎖のC 末端領域とインテグリンの間の相互作用およびその周辺で起こる局所的な構造変化を可視化することに成功した。これによりインテグリンを介したシグナル伝達の分子メカニズムの詳細が明らかになった。
研究の意義と将来展望
ES 細胞やiPS 細胞といった多能性幹細胞の表面にはインテグリンα6β1が多く存在し、ラミニン511をこれらの細胞を接着培養する際に足場(培養基質)として用いると、効率よく培養できることが知られている。ラミニン511は、既に多能性幹細胞の培養基質として実際に広く利用されているが、本研究により、インテグリンα6β1を活性化させる際のラミニン511のはたらきが明らかになったことから、より優れた培養基質の開発が可能になることが期待され、再生医療に大きく貢献すると考えられる。
担当研究者
教授 高木 淳一、准教授 有森 貴夫(蛋白質研究所 蛋白質化学研究部門)
キーワード
細胞接着/多能性幹細胞/小型抗体
応用分野
医療・ヘルスケア
