研究 (Research)
最終更新日:
細胞内極性輸送の分子メカニズムの解明と医療への応用 (Function of a gene involved in polarized transport and application to the therapy for human diseases)
助教 國井 政孝、教授 原田 彰宏(医学系研究科 細胞生物学) KUNII Masataka , HARADA Akihiro(Graduate School of Medicine)
研究の概要
動物の組織を構成する細胞は「極性」と呼ばれる方向性を持っており、細胞内での方向性を持った蛋白質輸送(極性輸送)が極性形成や生理機能に重要である。しかし、極性輸送関連分子の生体での機能については不明な点が多い。近年、我々は上皮細胞の頂端面への極性輸送に関わるSNAP23という蛋白質の組織特異的ノックアウトマウスの解析から、SNAP23が膵臓において腺房細胞からの消化酵素分泌を促進するが、β細胞からのインスリン分泌には抑制的に働いていることを見出した。更に、SNAP23阻害化合物であるMF286を同定し、MF286を投与したマウスではインスリン分泌が促進されることを発見した。また、発生中の脳においてはSNAP23が神経前駆細胞の極性形成を通して大脳皮質や小脳の正常な発生に重要な役割を持つことを見出した。
研究の背景と結果
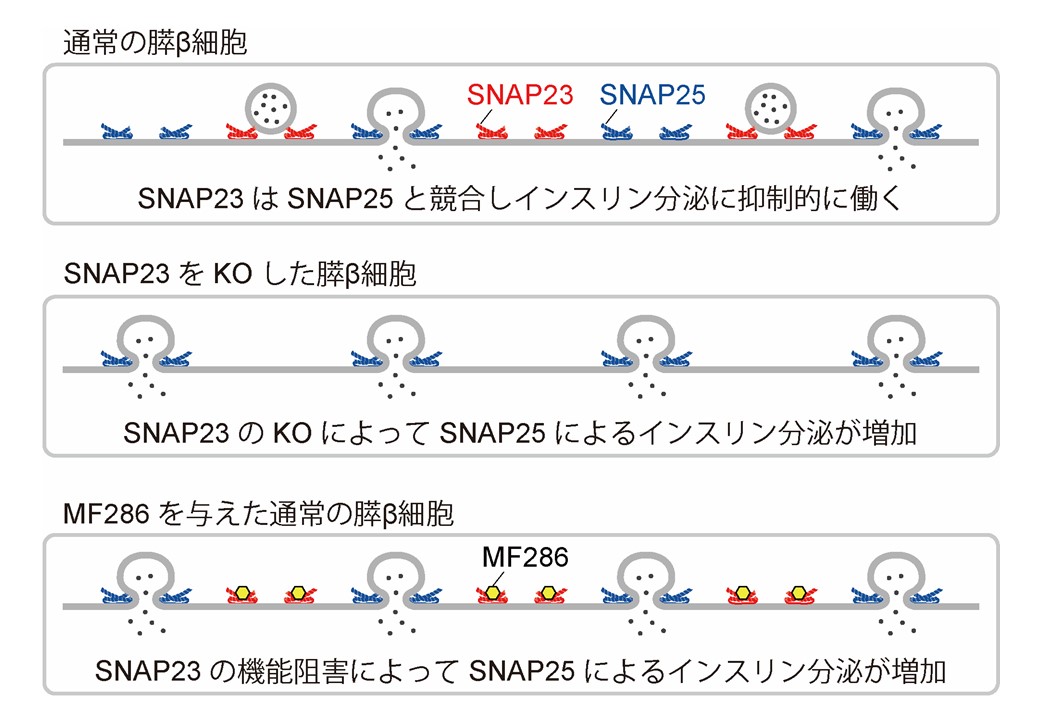
動物の組織を構成する上皮細胞や神経細胞はそれぞれ頂端側と側底側、軸索と樹状突起といった極性を持っている。このような極性細胞では、細胞内で合成された蛋白質がそれぞれの方向へ輸送される極性輸送というメカニズムが存在しており、極性の形成・維持や生理機能の発現に重要な役割を果たしている。これまで、極性輸送には多くの蛋白質が関与していることが報告されているが、それらの生体内での機能については不明な部分が多い。そこで我々は極性輸送関連分子の中で主に頂端面での膜融合に関与するSNARE蛋白質の一つ、SNAP23に着目した。生体内でのSNAP23の機能を解明するため、SNAP23ノックアウトマウスを作製したところ、全身でのノックアウトマウスは胎生致死となった。そのため、数種類の組織特異的ノックアウトマウスを作製し、解析を行った。膵臓外分泌腺特異的ノックアウトマウスでは消化酵素の分泌が減少したことから、SNAP23が膵臓からの外分泌を促進する機能が示唆された。
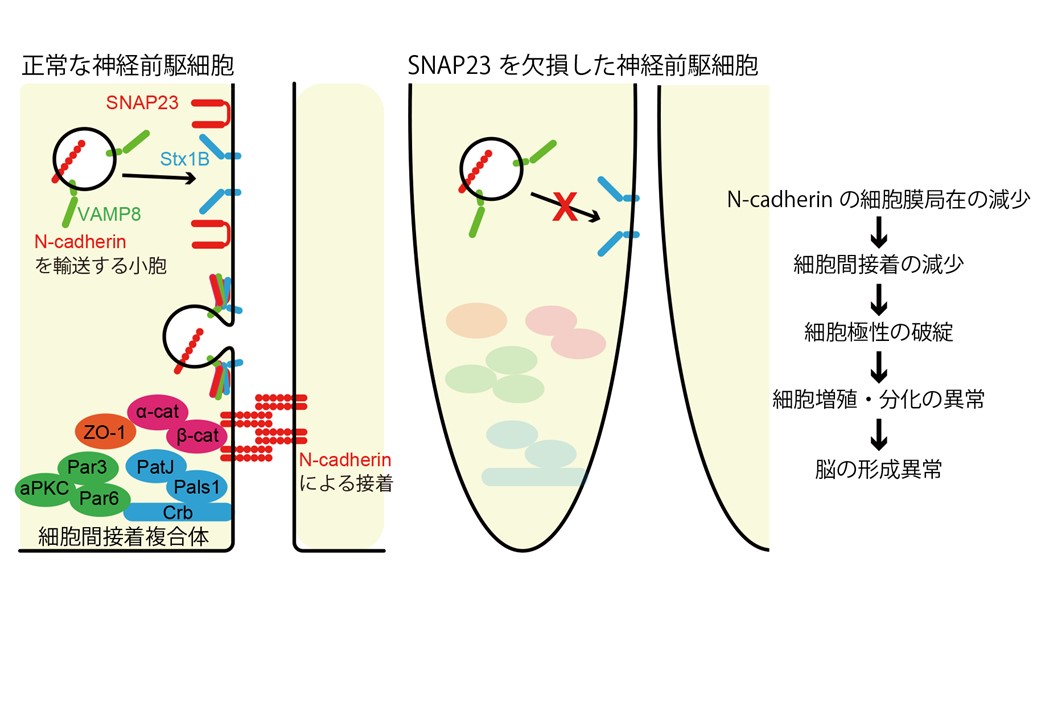
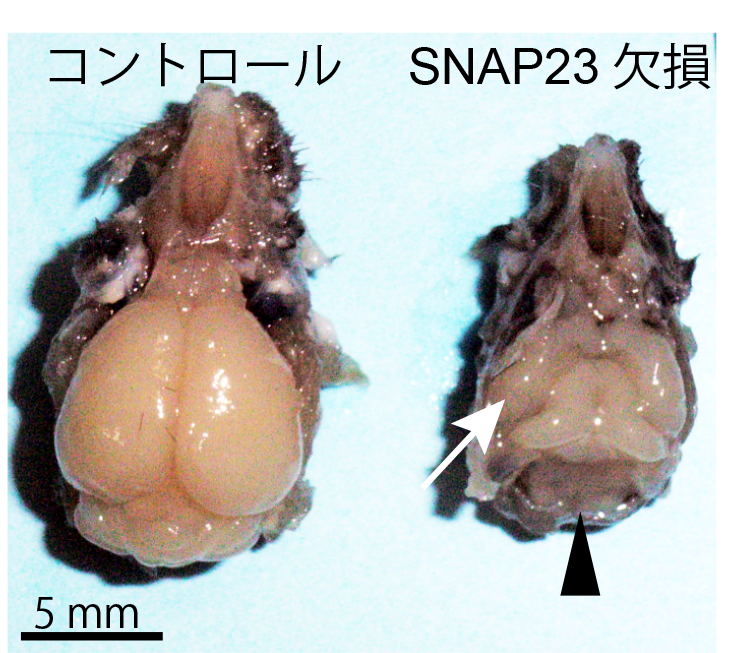
一方、膵臓内分泌腺特異的ノックアウトマウスではβ細胞からのインスリン分泌が増加し、マウスの耐糖能の改善が見られたことから、SNAP23がインスリン分泌には抑制的に働いていることが明らかとなった。このことはこれまで報告されていたSNAP23の機能とは全く逆の知見であった。この結果を受け、我々は理研と共同でSNAP23を阻害する低分子化合物MF286を同定し、MF286を投与したマウスではインスリン分泌量が増加することを確認した。更に我々は中枢神経系特異的ノックアウトマウスの解析を行った。中枢神経系特異的ノックアウトでは大脳皮質の著しい低形成や小脳の欠損といった重篤な組織形成異常が認められた。詳細な解析の結果、SNAP23が神経前駆細胞の頂端面において細胞間接着分子であるN-cadherinの細胞膜への局在化に機能していることが明らかとなった。ノックアウトマウスでは細胞間接着を失った神経前駆細胞が極性を失い、組織発生の異常へとつながったことが示唆された。
研究の意義と将来展望
SNAP23ノックアウトマウスの解析から、組織形成や生理機能における極性輸送機構の役割の一端が明らかとなった。SNAP23阻害化合物であるMF286がマウスでインスリン分泌促進の効果を示したことは、SNAP23が糖尿病治療の新しい標的分子となる可能性を示唆している。また、中枢神経系においても、大脳皮質の形態異常が生じる水頭症や二分脊椎、小脳の欠損が生じるダンディー・ウォーカー症候群などの疾患との関連も考えられ、将来的にこれらの疾患の診断や治療法開発へつながる可能性がある。
担当研究者
助教 國井 政孝、教授 原田 彰宏(医学系研究科 細胞生物学)
キーワード
細胞極性/極性輸送/SNAP23/インスリン分泌/神経発生
応用分野
医療・ヘルスケア/創薬
