研究 (Research)
最終更新日:
神経疾患の原因となるリピートRNA を標的とする低分子によるRNA 毒性緩和 (Alleviation of RNA toxicity by small molecules targeting repeat RNAs responsible for neurological diseases)
招へい教員 柴田 知範、教授 中谷 和彦(産業科学研究所 精密制御化学研究分野) SHIBATA Tomonori, NAKATANI Kazuhiko(SANKEN (The Institute of Scientific and Industrial Research))
研究の概要
ヒトゲノムには多種類のリピート配列が存在しており、異常に伸長したリピートは、リピート病と呼ばれる遺伝性の神経筋疾患を引き起こす。リピート病の発症機構の一つとして異常伸長リピートの転写産物であるリピートRNA が毒性を示すRNA の機能獲得機構が提唱されている。毒性リピートRNA の構造・機能を制御する低分子の創製は、リピート病の発症予防、症状緩和、進行抑制などの治療法開発につながると期待されている。我々は、これまでに核酸を標的とする低分子の開発を行ってきた。我々が開発した独自の核酸標的低分子を含む化合物ライブラリから脊髄小脳失調症31型(SCA31) の原因となるUGGAA リピートに結合する低分子を見出した。このリピート結合低分子が、リピートRNA とタンパク質の相互作用やUGGAA リピートのRNA 凝集体の形成を阻害し、SCA31モデルショウジョウバエにおいてUGGAA リピートによって引き起こされるRNA 毒性を緩和することを実証した。
研究の背景と結果
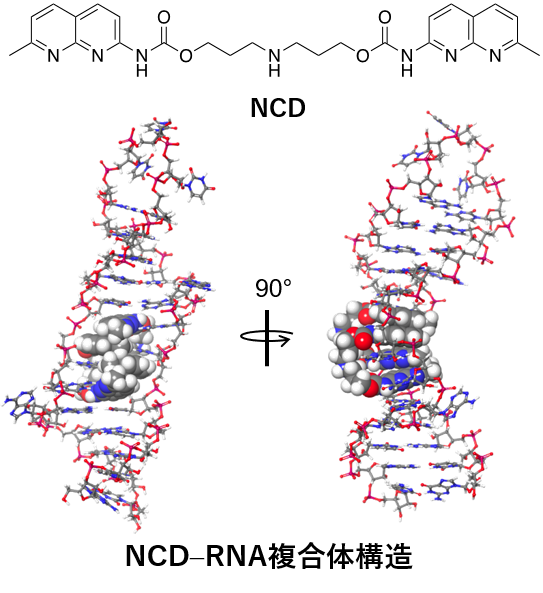
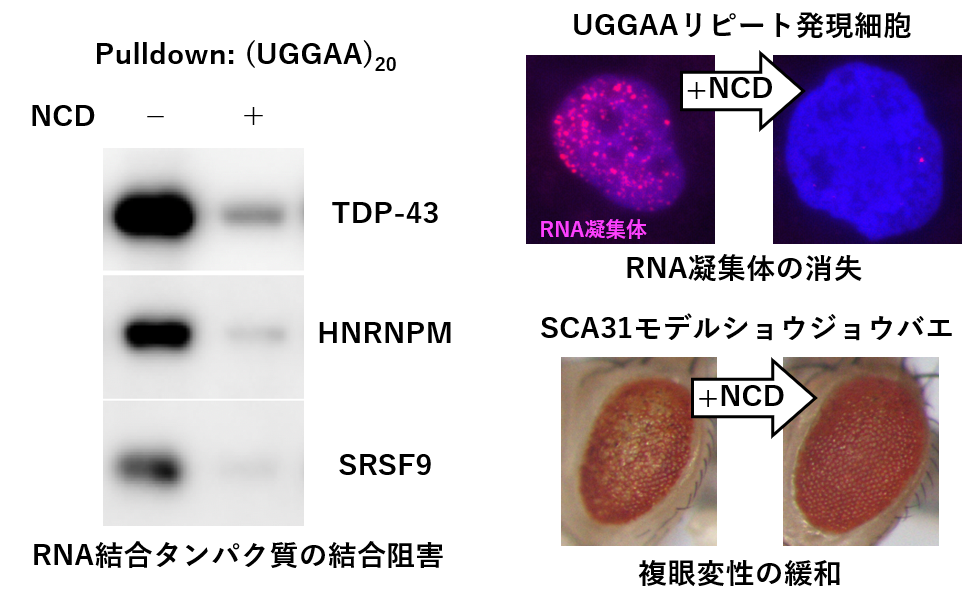
脊髄小脳失調症31型(SCA31) は、16番染色体にあるBEAN1 及びTK2 遺伝子が共有するイントロン領域へのTGGAA リピートの挿入が原因で発症する常染色体顕性遺伝性の脊髄小脳変性症である。異常挿入されたTGGAA リピートの転写産物であるUGGAA リピートは、RNA 結合タンパク質を捕捉し、核内に異常なRNA 凝集体を形成することで毒性を示すと考えられている。先行研究により、UGGAA リピート結合タンパク質として同定されたTDP-43がSCA31のRNA 毒性を緩和することが報告されている。これらの報告を基に、低分子によるSCA31のRNA 毒性緩和を目的としてUGGAA リピート結合低分子の探索に着手し、研究室独自の核酸結合性低分子ライブラリからナフチリジンカーバメートダイマー(NCD) を見出した。In vitro での相互作用解析及びNCD-RNA 複合体のNMR 解析により2分子のNCD がUGGAA リピートのインターナルループ構造にグアニンとの水素結合を介して結合した複合体構造の決定に成功した。In vitro pulldownアッセイにより、NCD のRNA– タンパク質相互作用に対する阻害効果を検証し、NCD がUGGAA リピートに対するRNA 結合タンパク質の結合を阻害することを明らかにした。また細胞核内に形成されるUGGAAリピートを含むRNA 凝集体に対する阻害効果をRNA fluorescencein situ hybridization により検討し、NCD がRNA 凝集体の形成を阻害することを見出した。UGGAA リピートの発現により複眼変性を示すSCA31モデルショウジョウバエを用いた実験では、NCD をショウジョウバエの幼虫に給餌することにより、複眼変性が抑制された。これらの結果より、UGGAA リピート結合分子であるNCD によりSCA31のRNA 毒性が緩和されることが実証された。
研究の意義と将来展望
RNA は、これまでundruggable な標的と考えられていたが、近年創薬標的として注目されている。疾患の原因となるRNA を標的とする低分子は、従来のタンパク質標的創薬では標的疾患と成り得なかった難治性疾患に対する新たな治療戦略を切り開く可能性を秘めている。リピートRNA 標的低分子の創製研究及びそれらの作用機序解明により、未だ治療法が確立されていないリピート病の治療法開発が期待される。
担当研究者
招へい教員 柴田 知範、教授 中谷 和彦(産業科学研究所 精密制御化学研究分野)
キーワード
RNA/リピート伸長病/RNA標的低分子/脊髄小脳変性症/創薬
応用分野
医療・ヘルスケア/創薬
参考URL
https://www.sanken.osaka-u.ac.jp/labs/rbc/index.html
https://www.sanken.osaka-u.ac.jp/hot_topics/topics_20210108/
