研究 (Research)
最終更新日:
抗がん剤後の骨髄回復を促すメカニズムの解明 (How bone marrow regenerates after chemotherapy)
教授 石井 優(医学系研究科・生命機能研究科 免疫細胞生物学)、助教 数藤 孝雄(医学系研究科 血液・腫瘍内科学) ISHII Masaru , SUDO Takao(Graduate School of Medicine)
研究の概要
抗がん剤治療の副作用として白血球などの血球細胞は減少する。骨髄内では生き残った造血幹・前駆細胞が盛んに分裂し、血球回復を促す機構が存在しているが、その詳しいメカニズムは分かっていなかった。本研究において、骨髄に存在する免疫細胞の一種である2型自然リンパ球(ILC2)が増殖因子GM-CSF を分泌することによって、抗がん剤投与後の骨髄回復に寄与していることを示した。ILC2は、細胞死によって放出されるIL-33刺激を感知し、下流のMyD88分子を介して活性化された。GM-CSF ノックアウトマウスは抗がん剤5-FU 投与で致死となる。しかし野生型由来ILC2を移植することにより、血球回復が促進され、致死性が回避された。これらの結果からILC2は、骨髄傷害を感知して反応し、骨髄再生を促進していることが明らかとなった。このように、本研究は骨髄傷害後の血球回復メカニズムを同定した。
研究の背景と結果
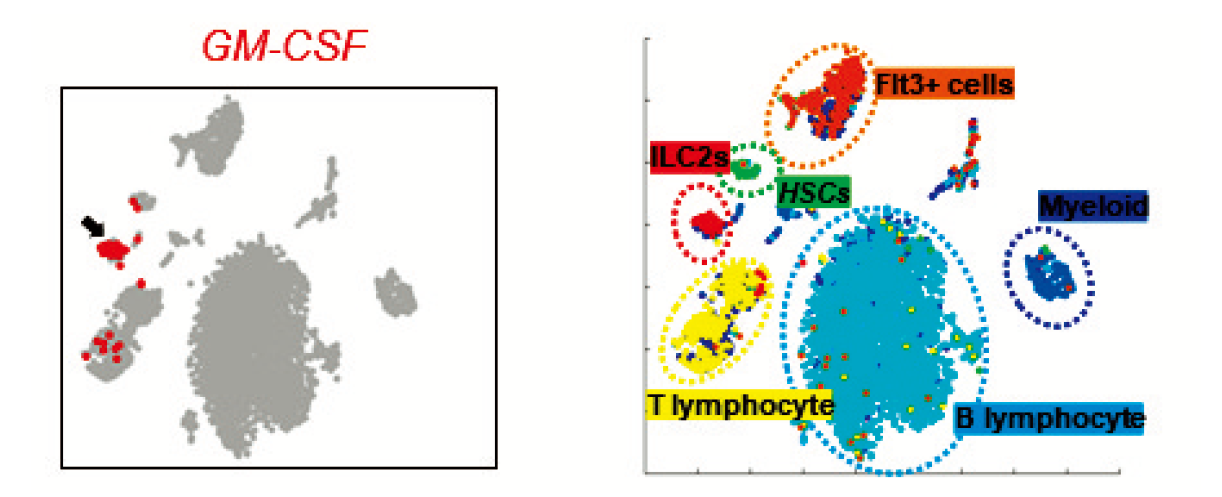
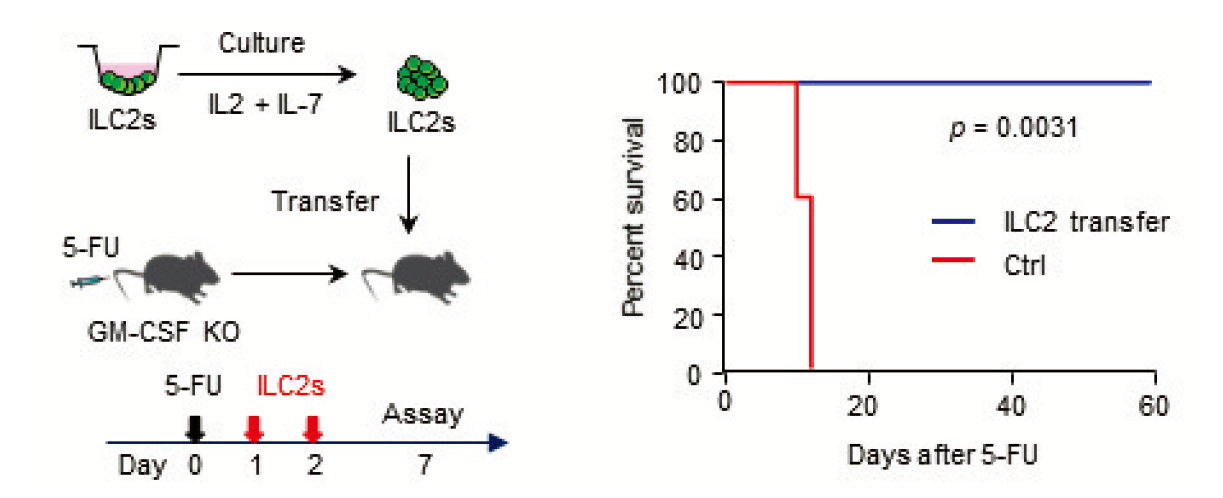
白血球などの血球細胞は、骨髄内に存在する造血幹・前駆細胞から産生される。通常は作られる細胞と壊される細胞のバランスがとられ、骨髄の細胞数はほぼ一定の数に保たれている。しかし抗がん剤治療を受けると、副作用として骨髄中の血球細胞が大きく減少し、感染症リスクが上がる。そのため骨髄内では生き残った造血幹・前駆細胞が盛んに分裂することによって血球を回復させることが知られているが、これまでその回復機構が惹起されるメカニズムは分かっていなかった。本研究において、生きた動物の生きた細胞を可視化する生体イメージング技術を用いて、抗がん剤5-FU 投与後の骨髄に移植された造血幹・前駆細胞の動きが通常と異なることを見出した。抗がん剤投与後のマウス骨髄に移植された造血幹・前駆細胞の遺伝子発現を網羅的に調べたところ、増殖因子の一種であるGM-CSF が骨髄回復に重要な働きをしていることが示された。GM-CSF 遺伝子欠損マウスでは、抗がん剤投与後の骨髄回復が遅延した。抗がん剤投与後骨髄細胞の遺伝子発現をシングルセルRNA-seq 解析を用いて調べたところ、2型自然リンパ球(ILC2)がGM-CSF を高発現する細胞集団であることが分かった。骨髄内のILC2は定常状態においてはGM-CSF をほとんど産生しなかったが、抗がん剤によって活性化されるとGM-CSF 産生が上昇した。IL-33欠損マウス及びMyD88欠損マウスにおいては、抗がん剤投与後ILC2のGM-CSF 遺伝子発現上昇が抑制された。このことから、ILC2の活性化メカニズムとしてIL-33-MyD88パスウェイが重要な働きをしていることが分かった。野生型マウス骨髄由来ILC2を体外で増幅し、抗がん剤投与後のマウスに移植することによって、血球細胞の回復を促進することができた。この結果から、骨髄にホーミングしたILC2は、GM-CSF 産生を通じて骨髄回復を促進することが示された。

研究の意義と将来展望
生体は元々、抗がん剤で傷ついた骨髄を再生させる能力があるが、その回復スイッチがどのような機序で発動するのかはよくわかっていなかった。本研究はその再生メカニズムの一つを明らかにした。更にILC2の細胞医薬としての可能性を示した。本研究成果は、造血幹細胞を体外で増やす方法の開発や、抗がん剤治療後の白血球減少症の治療法開発に役立つと考えられる。
担当研究者
教授 石井 優(医学系研究科・生命機能研究科 免疫細胞生物学)、助教 数藤 孝雄(医学系研究科 血液・腫瘍内科学)
※本学ResOUのホームページ「究みのStoryZ」に、インタビュー記事が掲載されています。是非ご覧ください。
石井 優
https://resou.osaka-u.ac.jp/ja/story/2018/jwhvw/
キーワード
顆粒球マクロファージコロニー刺激因子/2型自然リンパ球/生体イメージング
応用分野
医療/細胞医薬
