研究 (Research)
最終更新日:
膜蛋白質の化学合成と細胞膜貫入機構解明への応用 (Analysis of endocytosis using synthetic membrane protein)
教授 北條 裕信(蛋白質研究所) HOUJOU Hironobu(Institute For Protein Research)
研究の概要
細胞膜上には種々の膜蛋白質が存在し、細胞内外での情報や物質のやり取りをしています。多くは創薬ターゲットとして期待されており、それらの迅速な機能解明が待ち望まれます。しかし、膜蛋白質は極めて疎水性が高く、組換え DNA 法でも調製は容易ではありません。また、糖鎖等の翻訳後修飾を持つことが多く、構造が不均一となり、解析に必要な高純度試料を得ることが困難です。
我々は蛋白質の化学合成を行っています。化学合成法では、糖鎖やリン酸化等の種々な翻訳後修飾を任意の場所に導入可能であり、それらの機能を正確に解析することができます。本研究では、カベオラと呼ばれる細胞膜上のくぼみを起点として細胞内へ物質が取り込まれる、カベオラエンドサイトーシスの機構を解明するため、カベオラを構成する膜蛋白質、カベオリンを化学合成する方法を確立しました。その結果、合成カベオリンも天然物同様の立体構造を持つことが証明されました。
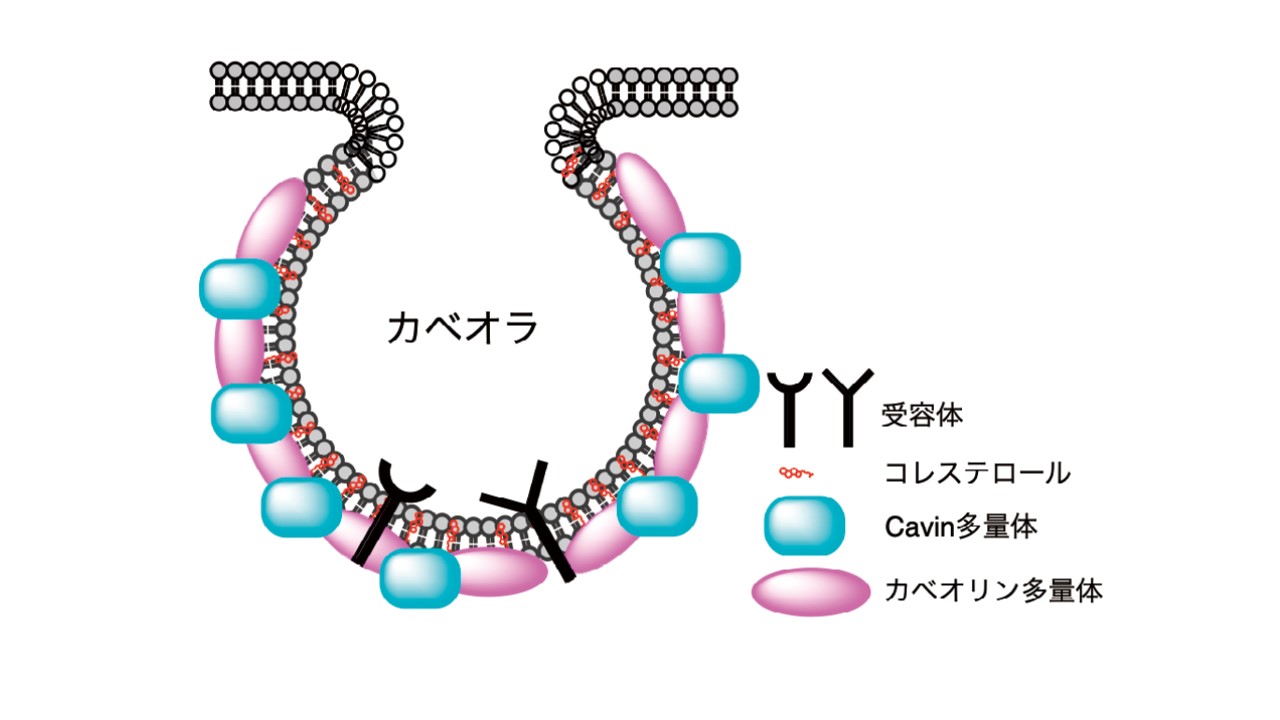
研究の背景と結果
蛋白質を化学合成する場合、全体のペプチド鎖をいくつかに分割し、自動合成機により各ペプチドを固相合成した後、精製します。そして、それらを縮合して全長のポリペプチド鎖を得ます。膜蛋白質の化学合成で問題になるのは、膜貫通部位が高度に疎水性であるため、この部分の溶解性が極めて低く、精製や他のペプチドとの縮合が進まないという点です。
そこでカベオリンの合成においては、膜に挿入されている疎水性の高い部分については、可溶化タグを付加して固相合成、精製し、縮合により全体のポリペプチド鎖を得た後、これらのタグを除去する方法を開発しました。また、カベオリンは C 末端に3つの脂肪酸(パルミチン酸)がエステル結合しているため、一層疎水性が高くなっています。そこで、パルミチン酸は、ペプチド鎖が組み上がった最後に特異的に導入し、合成途上での疎水性の上昇を避けることとしました。
最後に、あらかじめ調製したリポソーム、バイセル膜に埋め込むことにより、カベオリンのフォールディングを行いました。円二色性スペクトル等により構造確認すると、天然カベオリンと同様の二次構造を持つことが証明され、化学合成を利用してカベオリンの機能解明を行う基盤を確立することができました。今後、カベオリンがどのように多量体を形成するのか、またエンドサイトーシスを引き起こすのか、N 末端の複数のリン酸化の意味は何か等、カベオリンの機能解明の進展が期待できます。さらに、本合成法は他の膜蛋白質の合成にも適用可能であり、膜蛋白質解析に一般的に利用できるものと考えています。
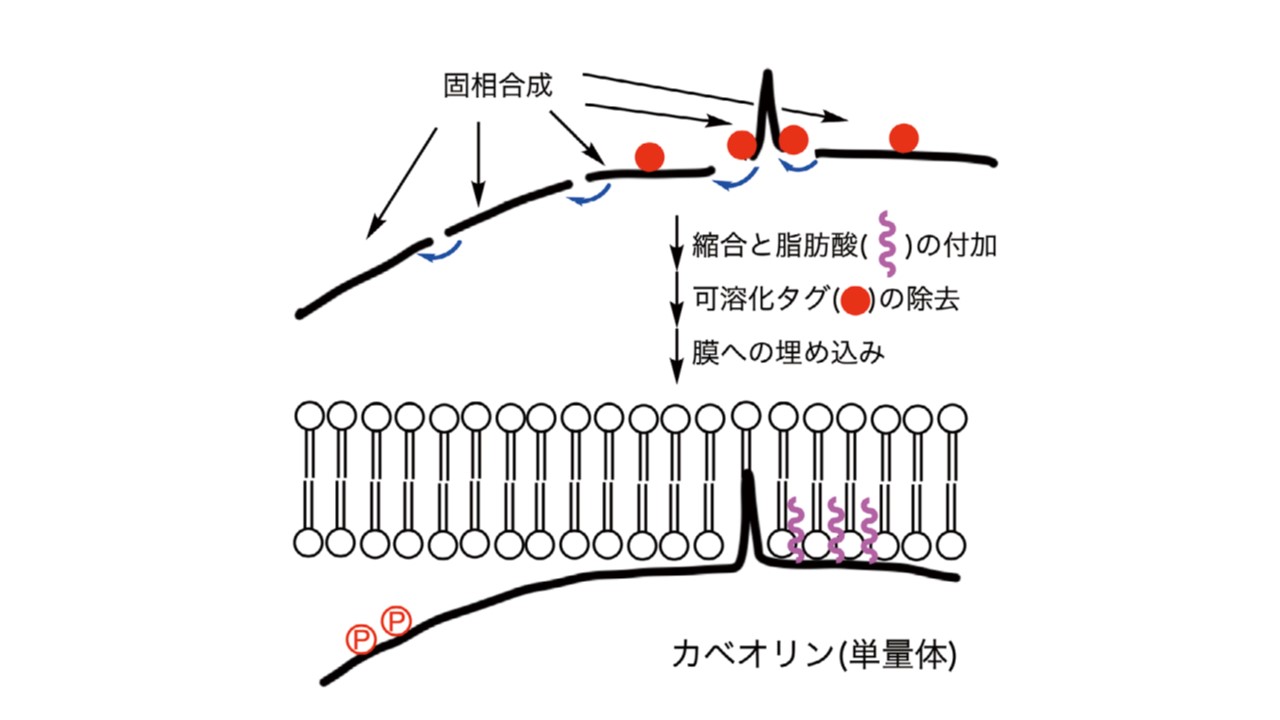
研究の意義と将来展望
膜蛋白質は、疎水性が高いため、化学合成も困難です。本研究では、合成途上はペプチド鎖の溶解性を向上させる官能基(可溶化タグ)を付加しておき、最終段階で可溶化タグを除去して膜に埋め込む手法により、膜蛋白質であるカベオリンの化学合成に成功しました。この方法は、他の膜蛋白質の合成にも応用可能であるため、今後、膜蛋白質の機能解明に大きく貢献できると考えています。
担当研究者
教授 北條 裕信(蛋白質研究所)
キーワード
カベオリン/膜蛋白質/化学合成/可溶化タグ/翻訳後修飾
応用分野
医療/創薬
