研究 (Research)
最終更新日:
がん細胞型アミノ酸トランスポーターを標的とする放射線療法 (Establishment of nuclear medicine targeting LAT1, cancer type amino acid transporter)
教授 兼田(中島)加珠子(理学研究科 附属フォアフロント研究センター) KANEDA-NAKASHIMA Kazuko(Graduate School of Science)
研究の概要
本研究では、がん細胞型アミノ酸トランスポーターLAT1*1をターゲットとした新たなアルファ線治療薬(アスタチン*2標識芳香族アミノ酸誘導体211At-AAMT)の開発を目標としました。LAT1はがん特異的に発現するアミノ酸トランスポーターです。その機能を阻害することで抗腫瘍効果を持つことが知られていましたが、LAT1を標的とする核医学治療薬の開発は進んでいませんでした。我々は核物理研究センターの加速器を用いて、アスタチン(211At)を製造し、LAT1高選択性の化合物に標識することで、LAT1を標的とする核医学治療薬の開発を行いました。
今回、開発した治療薬を膵臓がんモデルマウスに投与したところ、腫瘍への選択的集積ならびに増殖抑制効果が確認されました。治療薬はアミノ酸トランスポーターLAT1を介してがん特異的にデリバリーされることが分かりました。つまり、本治療薬はがん細胞に栄養分として取り込まれた後、細胞内部からがんを攻撃することができます。これにより、難治性の膵臓がんのみならず、治療薬のない様々ながんに対する画期的な治療法になることが期待されます。
*1 LAT1: L-type amino acid transporter 1; 大型中性アミノ酸トランスポー
ター。分岐鎖アミノ酸と芳香族アミノ酸を優先的に輸送するヘテロ二量体膜輸
送タンパク質。
*2 アスタチン: Astatine; 原子番号85の元素。元素記号は At。ハロゲン元素。
安定同位体は存在しない。同位体は約30個。半減期が短くギリシア語の不安
定という astatos を語源とする。
研究の背景と結果
近年、治療効果が高く、周囲の正常細胞への副作用が少ないアルファ線を用いた治療が注目を集めています。これまでのアルファ線治療薬はがん細胞表面に現れる特定の分子をターゲットにしていました。しかし、それらの分子はがん種によって異なることが多く、転移した部位では発現が変化することがありました。LAT1はがん種を問わず発現している上、がんの増悪度と相関している優れたがんの治療標的です。また、大阪大学はアルファ線核種であるアスタチンの製造で世界をリードするグループの一つです。
本研究では、大阪大学核物理研究センター、理化学研究所、ならびに短寿命 RI 供給プラットフォームを利用して、アスタチンの供給を受けました。大型加速器を用いて、荷電粒子をターゲットに照射することでアルファ線放出核種であるアスタチン(211At、半減期7.2時間)を製造し、本学放射線科学基盤機構の設備を利用して、分離精製を行いました。その後、LAT1高選択性のアミノ酸化合物であるアルファメチルチロシンに結合させることで、がん特異的に集積する注射薬(アスタチン標識芳香族アミノ酸誘導体211At-AAMT)の製造に成功しました。
本治療薬を膵臓がんモデルマウスの静脈内に単回投与したところ、腫瘍に選択的に集積し、腫瘍の増殖抑制効果が認められました(図1)。がん細胞を特異的にアルファ線で攻撃することにより、治療効果が得られることが確認されました。また、正常細胞にはほとんど取り込まれないことも確認されました。またメラノーマ(ほくろのがん)肺転移モデルにおいて、単回投与により転移を抑えることができることが示されました(図2)。今後、本治療薬の最適化を行い、将来的には様々ながんの患者さんにとって、有効な治療となることを目指しています。
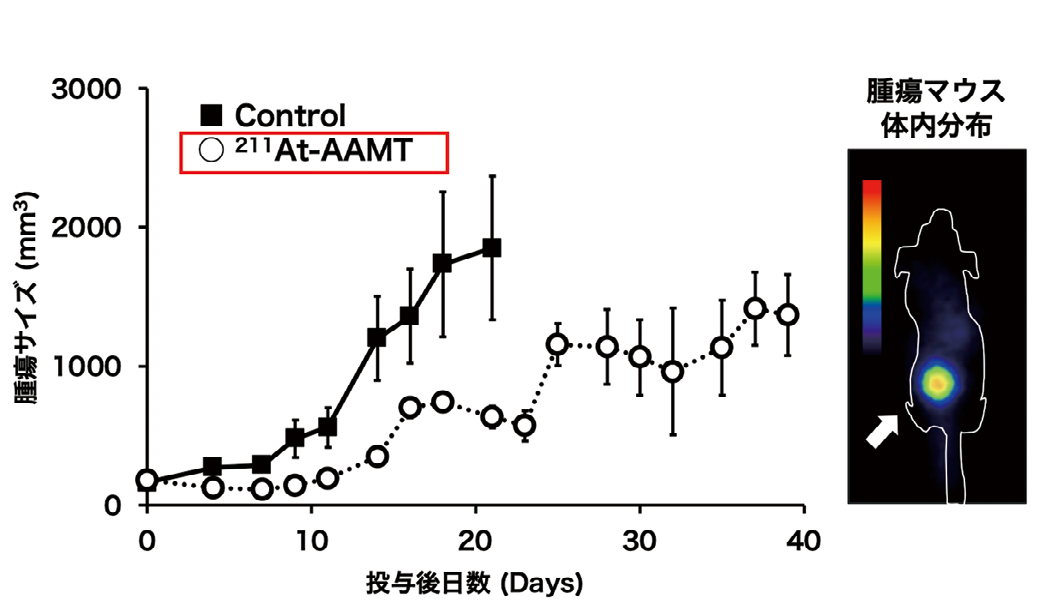
マウスにおける211At-AAMT の腫瘍(矢印)への集積画像 (右)

研究の意義と将来展望
アルファ線核医学治療は注射薬による全身治療であり、多発転移のある進行がんにも用いることができます。本研究成果として開発に成功したアスタチン標識アルファメチルチロシン注射薬は、膵臓がんをはじめとする難治性がんにおける、画期的な治療法となることが期待されます。
担当研究者
教授 兼田(中島)加珠子(理学研究科 附属フォアフロント研究センター)
キーワード
核医学治療/アルファ線/アスタチン/アミノ酸/トランスポーター
応用分野
医療・ヘルスケア/創薬/加速器技術
