研究 (Research)
最終更新日:
硫黄を上手く使ってインドールの精密化学修飾を実現 (Sulfur-directed site-selective functionalization of indole derivatives)
准教授 西井 祐二(工学研究科 応用化学専攻)、特任教授 三浦 雅博(先導的学際研究機構 触媒科学イノベーション研究部門(ICS-OTRI)) NISHII Yuuji(Graduate School of Engineering) , MIURA Masahiro(Institute for Open and Transdisciplinary Research Initiatives)
研究の概要
ロジウム触媒およびイリジウム触媒を用いた、インドール類の直接化学修飾法を開発した。本手法では、硫黄原子を配向基(directing group)としての利用することにより、従来法を凌駕する高い位置選択性を達成することができた。触媒反応の後、硫黄配向基は容易に除去&変換することができる。この特徴を活かすことで、天然物などに見られる複雑な構造の縮環インドール化合物の合成に展開した。
研究の背景と結果
インドール化合物は多様な生物活性物質の基本骨格として偏在しており、代表的なものとしてトリプトファン(アミノ酸)、インドメタシン(抗炎症薬)、インジゴ(染料)、セロトニン(神経伝達物質)などが挙げられる。インドール構造を含む機能性分子を効率的に得るためにも、新たな合成手法の開発は常に求められてきた。最近では、有機分子中にありふれた炭素-水素結合を金属触媒により切断し、直接的に化学反応の起点とする「C-H 活性化」反応の発展は目覚ましく、この戦略に基づいたインドール骨格の化学修飾法も開発が進められてきた。
インドールはピロール環とベンゼン環が縮合した構造を持っており、より活性の高いピロール環で優先的に化学反応が起こることが常識と考えられている。この選択性を逆転させ、本質的に低活性なベンゼン環のみで化学反応を起こすことができれば、従来の合成プロセスを大幅に短縮し、新たな機能性分子を創出するための強力な合成ツールになり得る。その解決策として、私たちの研究グループでは、金属イオンを強力に引き付ける硫黄原子の特性(=配向基として機能する)に着目し、位置選択的なカップリング反応を新たに開発した。求電子性の高い硫黄試薬を用いることで、インドールの1位(窒素原子上)および3位(炭素原子上)に硫黄配向基を導入することができた。これら配向基はそれぞれ、塩基性条件下・還元条件下にさらすことで容易に除去できることに加えて、ニッケル触媒を用いたカップリング反応の起点としても利用可能である。配向基による近接効果によって、4位および7位の炭素-水素結合を選択的に切断し、触媒的な炭素-炭素結合形成反応(アルケニル化・アルキニル化・アシルメチル化)を達成した。得られたカップリング生成物を更に化学変換することで、インドールアルカロイドの部分骨格に含まれるような、複雑な縮環インドール構造を構築することにも成功した。
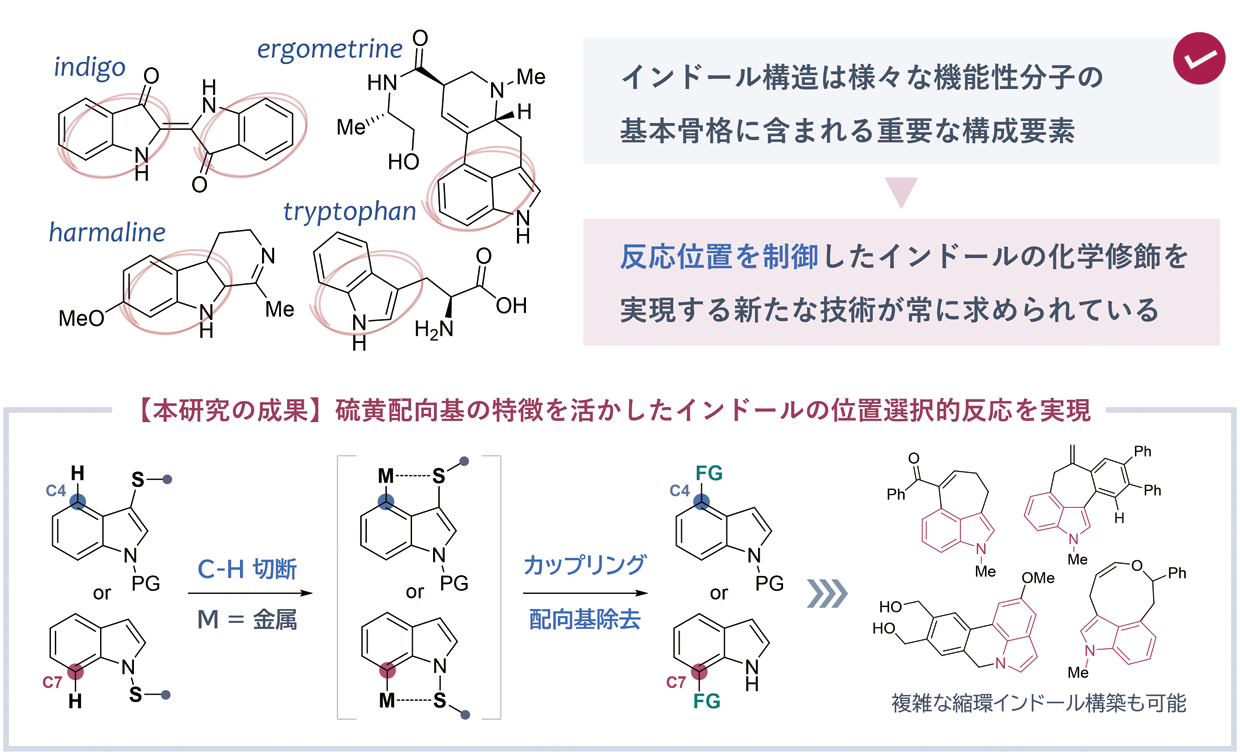
研究の意義と将来展望
インドール化合物は多様な機能性分子の基礎となっており、特に医薬研究分野においては「privileged =特権階級」と呼ばれるほど重要視されている。こうした背景から、反応位置を制御してインドール骨格を化学修飾する新たな手法の開発は、近年注目を集めてきた。特に、本質的に反応性の低いベンゼン環(インドール C4~C7位)を狙って反応させるには、相応の工夫が必要であった。
本研究では、硫黄配向基を用いてこの課題を解決しており、その着脱の容易さに着目して、様々な縮環インドール構造の構築に応用ができることを実証した。この成果により、機能性分子の合成プロセスを短工程化できるとともに、従来法では構築の困難であった新規ビルディングブロックの創出を通じて、創薬・マテリアルサイエンスなど関連分野に波及効果が期待できる。
担当研究者
准教授 西井 祐二(工学研究科 応用化学専攻)、特任教授 三浦 雅博(先導的学際研究機構 触媒科学イノベーション研究部門(ICS-OTRI))
※本学ResOUのホームページ「究みのStoryZ」に、インタビュー記事が掲載されています。是非ご覧ください。
三浦 雅博
https://resou.osaka-u.ac.jp/ja/story/2015/201509_01/
キーワード
触媒化学/カップリング反応/インドール/遷移金属
応用分野
創薬/プロセス化学/有機EL
