研究 (Research)
最終更新日:
中枢神経炎症病態を緩和する分子標的治療の開発 (Novel therapeutic strategy for NMO: RGMa-mAb found effective against CNS inflammation)
特任教授(常勤) 糸数 隆秀(医学系研究科 創薬神経科学共同研究講座/分子神経科学)、教授 山下 俊英(医学系研究科 分子神経科学/創薬神経科学共同研究講座) ITOKAZU Takahide , YAMASHITA Toshihide(Graduate School of Medicine)
研究の概要
中枢神経組織内の炎症は種々の病態の進展に多大な影響を及ぼしており、その適切な制御方法の開発は、幅広い神経疾患に対する新規創薬に直接的に結びつく鍵となる。我々は重篤な神経障害を呈する視神経脊髄炎の動物モデルを用いて、中枢神経系の炎症を制御する新たな分子メカニズムを解明した。
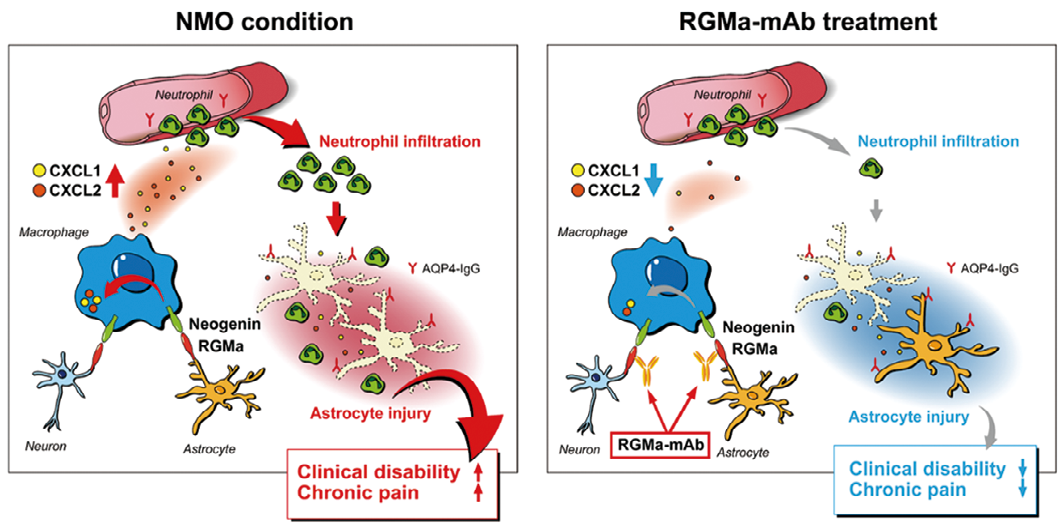
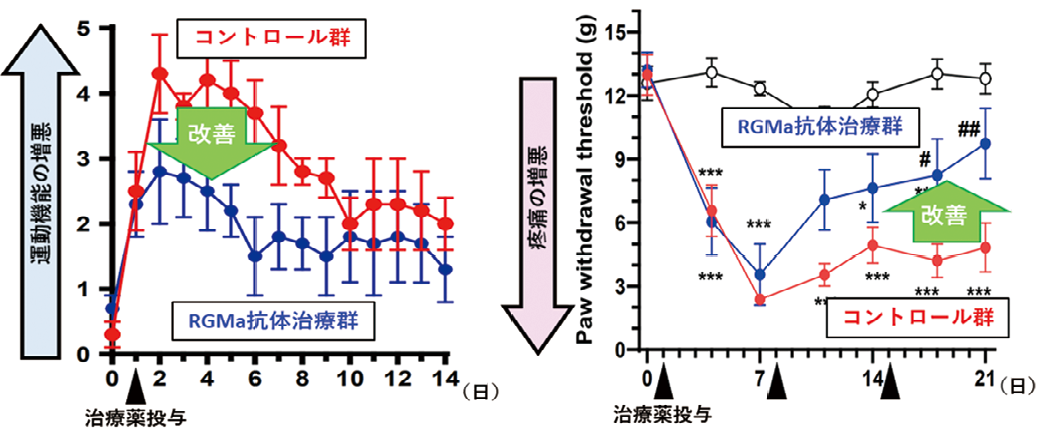
視神経脊髄炎では、自己抗体によるアストロサイト障害が契機となり、各種免疫細胞が中枢神経組織内に浸潤して高度の炎症を起こすことにより神経機能障害が生じる。我々は中枢神経系に浸潤したマクロファージが RGMa という分子を介するシグナルを受け取ることで、好中球を呼び寄せて炎症をさらに加速させていることを見出した。NMO モデル動物に抗 RGMa 中和抗体(RGMa の機能を阻害する)を投与したところ、好中球の浸潤抑制およびアストロサイト障害の緩和効果が得られ、運動症状が大きく改善した。さらにこのモデル動物が臨床上大きな問題となる神経障害性疼痛を呈することを明らかにし、RGMa 中和抗体が疼痛症状の遷延を抑制できることも示した。
研究の背景と結果
視神経脊髄炎(neuromyelitis optica: NMO)は重篤な視神経炎や脊髄炎が出現する難病で、中枢神経内のアストロサイトを標的とした自己抗体(抗アクアポリン4抗体)によってアストロサイトが障害されることを契機とし、種々の免疫細胞が浸潤して高度の炎症を起こすことにより神経回路が損傷を受け、神経機能障害が生じるものと考えられているが、詳細なメカニズムについては不明な点も多い。
これらの病態を詳細に解析するため、高親和性抗アクアポリン4モノクローナル抗体を用いて作製した NMO モデルラットで検証を行った。本モデル動物の脊髄では、NMO 患者と同様に、病変部位の血管から抗アクアポリン4抗体が中枢神経内に漏れ出し、アストロサイトが障害されていた。同部位においては多数のマクロファージや好中球の浸潤がみられた。そこで詳細な組織学的解析を行い、脊髄内の神経細胞およびアストロサイトが RGMa という分子を発現していること、さらに、浸潤してきたマクロファージが RGMa の受容体である Neogenin を強く発現していることを見出した。これらの結果は、NMO 患者の病理組織を用いた検証でも確認された。そこで、発症後に抗 RGMa 中和抗体を投与してその治療効果を検証したところ、運動機能障害の増悪を抑制する効果があることが確認できた。
また、臨床上大きな問題になっている NMO に関連した慢性疼痛について、これまで適切な動物モデルが無いことが問題であったが、今回我々は本 NMO モデルラットが顕著な疼痛症状を呈することを発見し、神経障害性疼痛の病態研究モデルとして有用であることを示した。さらにRGMa 中和抗体の効果についても検証し、本抗体治療が疼痛症状の遷延を抑制できることを示した。
さらにメカニズム検証を進め、マクロファージが RGMa シグナルを受け取ることで CXCL2などのケモカインを過剰に産生するようになることを見出した。実際、抗 RGMa 抗体で治療した動物では、病変部のマクロファージの数には大きな変化がない一方で、ケモカインの産生、および好中球の浸潤が著明に抑制されており、アストロサイト障害も緩和されていた。
以上の結果から、中枢神経内に浸潤したマクロファージが RGMa を介したシグナルを受け取ることでケモカインを過剰に産生して好中球を呼び寄せ、神経炎症をさらに増悪させている可能性が示唆された。
研究の意義と将来展望
本研究成果により、既存の治療薬とは異なる作用点をもった NMO の急性期治療薬開発の可能性が拓かれた。今回明らかになったマクロファージと好中球の連関はさまざまな神経疾患における神経炎症病態に共通している可能性が高く、今後、幅広い神経疾患に対して抗RGMa 抗体が有効な治療法となることが期待される。
担当研究者
特任教授(常勤) 糸数 隆秀(医学系研究科 創薬神経科学共同研究講座/分子神経科学)、教授 山下 俊英(医学系研究科 分子神経科学/創薬神経科学共同研究講座)
キーワード
視神経脊髄炎/マクロファージ/RGMa
応用分野
医療・ヘルスケア/創薬
