研究 (Research)
最終更新日:
T細胞受容体レパトア解析を用いた免疫チェックポイント阻害剤早期奏効予測バイオマーカーの探索 (Peripheral T cell receptor repertoire features predict durable responses to anti-PD-1 inhibitor monotherapy in advanced renal cell carcinoma)
助教 加藤 大悟、教授 野々村 祝夫(医学系研究科 泌尿器科学) KATOU Taigo , NONOMURA Norio(Graduate School of Medicine)
研究の概要
近年、多癌種において免疫チェックポイント阻害剤(Immune checkpoint inhibitor, ICI)が使用可能となったが、奏効率は20-30%と限定的であり、今後は適切な患者選択を行うための確固たる奏効予測マーカーの確立が急務である。我々は、ICI 使用例における末梢血および腫瘍浸潤 T 細胞の T 細胞受容体(T cell receptor, TCR)レパトア解析を行い、早期奏効予測マーカーの探索を行った。進行性腎癌患者において PD-1阻害剤治療前後の PBMC を用いて TCR シーケンスを施行したところ、奏効群において Diversity Index が治療開始1ヶ月後で有意に低下し、特定の T 細胞クローンが増加していた。また奏効群では非奏効群と比較して治療後に高頻度 T 細胞クローンが末梢血中で有意に増加し、その一部は PD-1阻害剤投与前の腫瘍組織浸潤 T 細胞と共通していた。以上から ICI 奏効例では、治療後早期に特定の T 細胞クローンが末梢血中で増加し、腫瘍抗原特異的 T 細胞として全身循環し得ることが示された。
研究の背景と結果
近年、複数の癌種に適応である免疫チェックポイント阻害剤(Immune checkpoint inhibitors, 以下 ICI)は、前治療を経た症例に対しても一定の効果があり、適応が拡大している。しかし奏効率は限定されており、重篤な自己免疫疾患を発症する例もあることから、奏効例や非奏効例を治療前あるいは治療後早期に予測できるバイオマーカーの確立が急務である。
これまでに ICI の奏効例予測に関連する報告は2つあり、1)腫瘍組織 に お け る 体 細 胞 変 異 数 が 多 い 症 例、2 )腫 瘍 組 織 に お け るProgrammed death-ligand 1(PD-L1)高発現症例において奏効例が多いというものがあった。しかしいずれも明確なカットオフ値が定められず、確固たる予測マーカーとは成り得ていない。また治療前に奏効を予測することに重点が置かれており、治療後の多様な免疫応答の経過を捉えきれない点に問題があった。
そこで我々は ICI の奏効を左右する因子として、治療前後の細胞傷害性 T 細胞(主に CD8+T 細胞)やその役割を補助する CD4+T 細胞などが患者ごとにどの様に振る舞うかを時間軸と共に解明することが必要であると考え、その多様性を網羅的に解析し得る T 細胞受容体(T cell receptor, TCR)レパトア解析を行った。進行性腎癌患者においてPD-1阻害剤治療前後の PBMC を用いて TCR シーケンスを施行したところ、奏効群においてDiversity Index(DI)がニボルマブ開始1ヶ月後、3ヶ月後に有意に低下しており、奏効例においては特定の T 細胞クローンが末梢血中で増加していた。また DI が低下した群では、増加群と比較し有意に無増悪生存期間が延長した。また奏効群では非奏効群と比較して治療1ヶ月後、3ヶ月後に高頻度の T 細胞クローンが末梢血中で有意に増加し、その一部は PD-1阻害剤投与前の腫瘍組織中にも存在した。以上から ICI 奏効例では、治療後早期に特定の T 細胞クローンが末梢血中で増加し、腫瘍抗原特異的 T 細胞として全身循環し、遠隔転移巣を攻撃し得ることが示された。
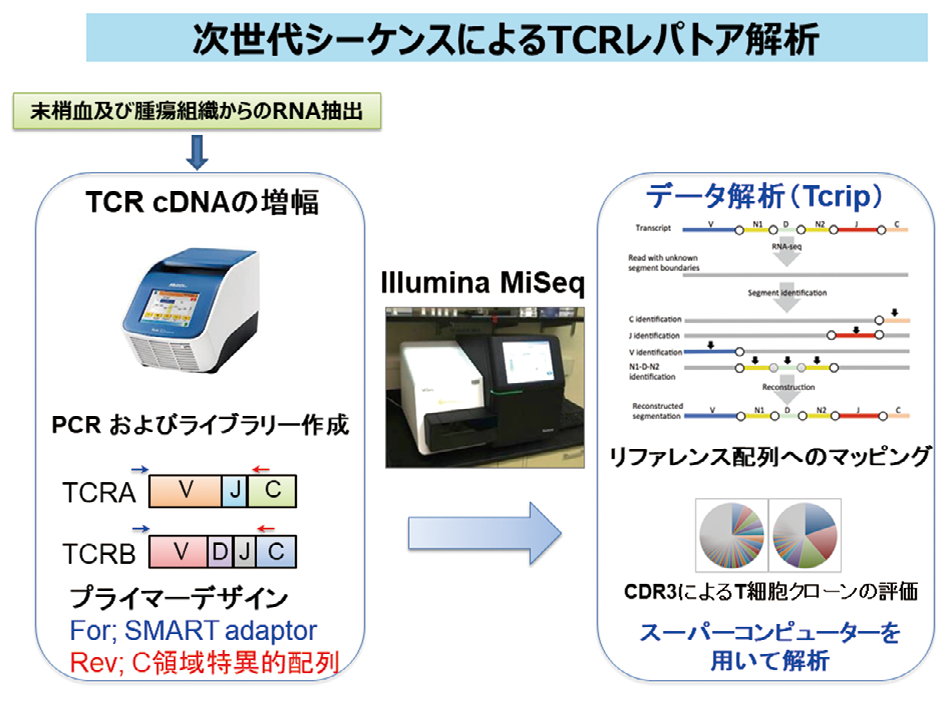
胞受容体α / β鎖のレパトア解析を行い、抗原認識部位である相補性決定領域
(CDR3)の配列を決定する。
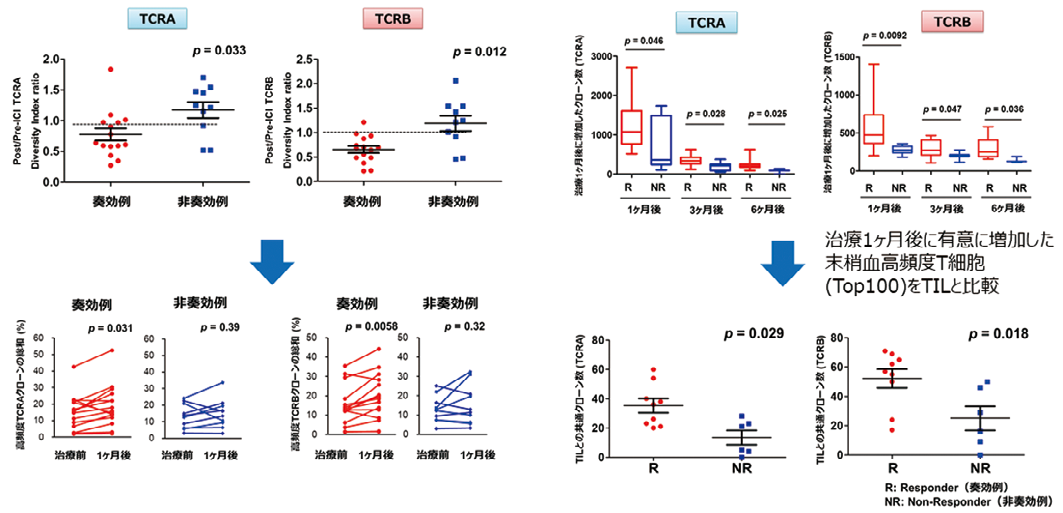
始1ヶ月後に有意に低下し、Top10クローンの総和も増加傾向であり、主要な T
細胞クローンが末梢血中で有意に増加したと考えられた。また奏効例では PD-1
阻害剤投与1ヶ月後に増加したT細胞クローンが有意に多く、これらは投与3・6ヶ
月後でも血中に残存し、長期に渡る抗腫瘍効果を示すと考えられた。
研究の意義と将来展望
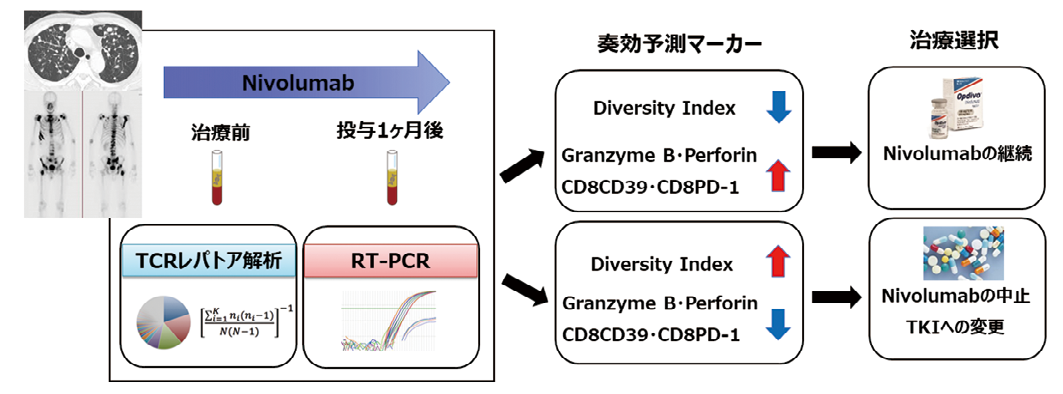
TCR レパトア解析による末梢血 T 細胞の DI やクローン数の増減は、ICI 治療後早期に奏効を予測し、治療を継続あるいは中止するための簡便なバイオマーカーになると考えられた。将来的には、奏効例において有意に増加した T 細胞クローンが同定できれば、ネオアンチゲンに反応する TCR 配列を決定し、ネオアンチゲン特異的な TCR 遺伝子導入 T 細胞輸注療法など患者ごとの個別化免疫療法へと展開する。
担当研究者
助教 加藤 大悟、教授 野々村 祝夫(医学系研究科 泌尿器科学)
キーワード
腎細胞がん/免疫チェックポイント阻害剤/T 細胞受容体/次世代シーケンス/バイオマーカー
応用分野
医療・ヘルスケア/コンパニオン診断薬
