研究 (Research)
最終更新日:
染色体凝集を担うタンパク質HP1の新たな機能 (Novel function of HP1, a protein responsible for chromosome aggregation)
特任助教 前田 亮、教授 立花 誠(生命機能研究科 エピゲノムダイナミクス研究室) MAEDA Ryo , TACHIBANA Makoto (Graduate School of Frontier Biosciences)
研究の概要
真核生物の染色体は、ヒストンとよばれるタンパク質複合体に DNAが巻きついた構造をとる。ヒストンにメチル化やアセチル化などの化学修飾が施されることで染色体の凝集や弛緩が誘導され、その結果、遺伝子の発現量が変化する。HP1は、ヒストン修飾のひとつ H3K9メチル化の結合タンパク質として同定され、染色体を凝集させる役割を持つ。
ほ乳類には三種類の HP1タンパク質が存在することから、今回私たちは、ゲノム編集技術により三種類の HP1全てを欠損させた細胞を樹立し、正常な細胞と比較した。その結果、HP1欠損細胞では、H3K9のメチル化酵素と脱メチル化酵素が著しく分解され、染色体が正しい構造をとれなくなることが明らかとなった(図1)。機能を一部欠損させた HP1変異体による解析から、HP1は、H3K9メチル化酵素や脱メチル化酵素を染色体に繋ぎ止め、これら酵素の分解を防ぐことが判明した(図2)。
研究の背景と結果
H3K9メチル化は遺伝子発現が抑制された領域にみられるヒストン修飾である。HP1は H3K9メチル化結合タンパク質として同定された。ほ乳類では HP1は三種類の類似した遺伝子によってコードされており、これまで、HP1のいずれか二種類を欠損した細胞では、目立った表現型は観察されていなかった。そこで私たちは、HP1の正確な機能を知るために、三種類の HP1をすべて欠損させた細胞を樹立し、解析をおこなった。
はじめに私たちは、HP1は H3K9メチル化酵素と結合することに着目した。HP1に結合できない H3K9メチル化酵素は不安定だという先行研究から、HP1は H3K9メチル化酵素のタンパク質安定性に関わるのではないかと仮説を立てた。マウス ES 細胞を用いて、ゲノム編集技術により三種類の HP1全てを欠損させたところ、H3K9メチル化酵素タンパク質が大幅に減少することが明らかとなった。HP1完全欠損細胞の核内を電子顕微鏡で見てみると、染色体の凝集領域と弛緩領域の区別がつかないことが判明した(図1)。これらの結果から、HP1はH3K9メチル化酵素のタンパク質を安定化し、染色体構造の維持に必須であることが明らかとなった。
つぎに、HP1がどのように H3K9メチル化酵素を安定化するのか解明するために、機能が一部欠損した HP1変異体を用いて生化学解析をおこなった。H3K9メチル化酵素には結合できるが H3K9メチル化に結合できないHP1変異体は、H3K9メチル化酵素を安定化できなかった。このことから、これらの酵素を安定化には、HP1と酵素の結合だけでなく、HP1が染色体に結合することも必要だと考えられた。
また、HP1は H3K9を除く働きをする酵素も同様に安定化することも明らかとなった。以上の結果から、HP1は、H3K9メチル化酵素・脱メチル化酵素を染色体につなぎ安定化するハブの役割を持つことが証明された(図2)。
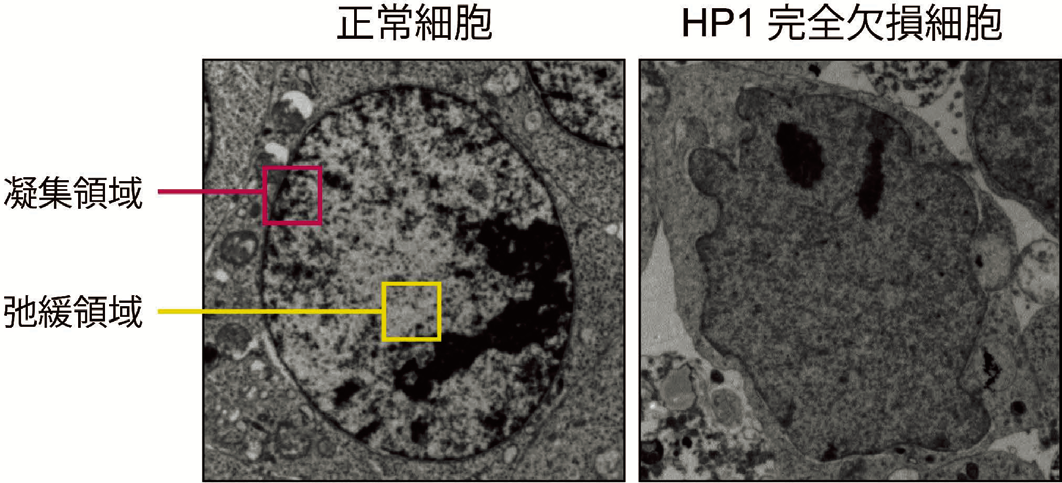
正常細胞(左)の核では黒く染まった染色体の凝集領域(ピンク色部分)と、白
く染まった弛緩領域(黄色部分)が明確に区別できる。一方で、HP1完全欠損細
胞(右)の核は画像の濃淡が消失しており、染色体の凝集領域と弛緩領域の区別
がつかない。
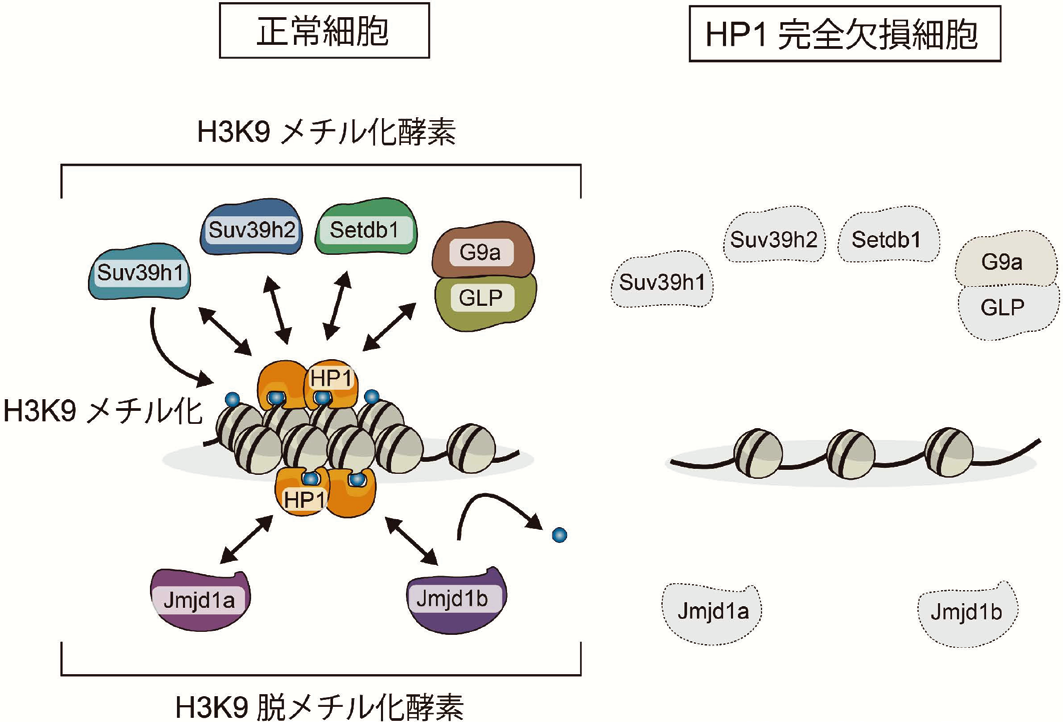
HP1は H3K9メチル化酵素・脱メチル化酵素と染色体上で複合体をつくることで
これらの酵素を安定化する(左)。HP1が欠損すると、これらの酵素は分解され、
染色体構造の崩壊が引き起こされる(右)。
研究の意義と将来展望
本研究により、HP1とH3K9メチル化酵素・脱メチル化酵素の結合が、これら酵素の安定化に必須であることが明らかとなった。がんなどのさまざまな疾患で H3K9メチル化の異常が観察される。これらの酵素と HP1の結合領域に入り結合を阻害、あるいは促進する薬物を開発することで、H3K9メチル化の異常が原因の疾患に対する治療法を提案できると考えている。
担当研究者
特任助教 前田 亮、教授 立花 誠(生命機能研究科 エピゲノムダイナミクス研究室)
キーワード
染色体/遺伝子発現制御/ヒストン修飾
応用分野
医療・ヘルスケア/創薬
参考URL
https://tachibana-lab.net
https://researchmap.jp/rmaeda1990
https://researchmap.jp/read0192906
