研究 (Research)
最終更新日:
電気信号を化学反応に変換する電位感受性酵素VSPの分子機構 (Molecular mechanisms of electrochemical conversion in voltage-sensing phosphatase)
特任研究員(常勤) 水谷 夏希(蛋白質研究所)、教授 岡村 康司(医学系研究科 統合生理学) MIZUTANI Natsuki (Institute for Protein Research) , OKAMURA Yasushi (Graduate School of Medicine)
研究の概要
全ての生物は電気信号(細胞膜の電位変化)を巧みに利用して生命活動を維持しています。古くからこの電気信号は、細胞膜に存在するイオンチャネルというタンパク質によって細胞内外間のイオンの流れに変換されることが知られてきました。一方近年、精子や腸にて、電気信号を酵素の働き(化学信号)に変換する電位依存性ホスファターゼ(VSP)というユニークなタンパク質が発見され、精子の運動や栄養吸収の制御において重要な役割を担っていることが明らかになりました。しかしながら、どのようにして VSP が信号変換を引き起こすのかは全くの謎でした。本研究で我々は、電気信号を感知する電位センサーと酵素領域との直接相互作用によって信号が変換され、酵素の働きが誘導されることを解明しました。
研究の背景と結果
VSP は細胞膜を伝わる電気信号を感知する電位センサーと、イノシトールリン脂質 PI(4,5)P2の脱リン酸化酵素を併せ持つユニークな酵素分子です。生体膜における電気信号を化学信号に変換する唯一の膜タンパク質として国内外で注目されてきましたが、どのようにして信号が変換されるかという根本的な分子メカニズムは明らかにされてきませんでした。
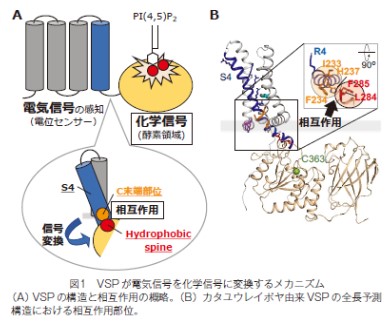
我々は、解析の進んでいなかった電位センサーの C 末端部位に新たに着目し、疎水性アミノ酸(イソロイシン・フェニルアラニン)が種を越えて保存されていることを発見しました。そこで、VSP のうちカタユウレイボヤ由来 VSP(Ci-VSP)をモデル分子に選択しアフリカツメガエル卵母細胞発現系を用いてアミノ酸変異導入実験と電気生理学計測を行ったところ、それらアミノ酸が電位センサーと酵素領域間の機能的なカップリング(共役)に重要な役割を果たすことを見出しました。これまでの当研究室での研究で、酵素領域にも Hydrophobic spine と名付けられた電位センサーと酵素領域間のカップリングに重要な役割を果たす部位が同定されており、電位センサーの C 末端部位に構造的に近接する可能性が示唆されました。
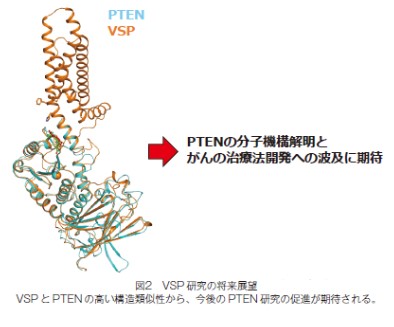
そこで、電位センサーのC 末端部位と Hydrophobic spine にそれぞれ蛍光を発する人工アミノ酸Anapとトリプトファンを導入したところ、酵素の働きの誘導に伴って Anap の蛍光の消光(クエンチング)現象が起こりました。また、両者にシステインを導入すると、酵素の働きの誘導によって架橋形成(クロスリンク)が確認されました。電位センサーの C 末端部位とHydrophobic spine との相互作用を示すこれらの結果と、構造予測から得られた知見を合わせ、この細胞膜近傍における2ヶ所の疎水性領域間の直接相互作用が酵素の働きを誘導する分子メカニズムのエッセンスであることが明らかになりました。さらに、VSP の酵素領域と高い構造類似性を持つがん抑制遺伝子 PTEN の構造を比較すると、PTENのN末端側のヘリックスがVSPでのカップリングに重要な電位センサーの C 末端部位のヘリックスに類似していたことから、酵素の機能調節が両者のタンパク質間で共通である可能性が示されました。
研究の意義と将来展望
本研究は、膜タンパク質における膜電位化学連関のシグナル伝達機構の詳細を初めて明らかにしたものであり、様々なタンパク質において本質的な役割を担うドメイン間の相互作用の新たな原理を提示するものです。
機能不全が不整脈やてんかんなどの疾患の原因となり得るイオンチャネルにおいては、電位センサーがイオンの流れを制御する原理の理解に繋がることが期待されます。また、VSP の酵素領域は細胞の腫瘍化を抑制する酵素 PTEN に構造が良く似ているため、本研究で得られた知見は PTEN の分子メカニズム解明を通して将来がんの治療法開発に繋がると期待されます。
担当研究者
特任研究員(常勤) 水谷 夏希(蛋白質研究所)、教授 岡村 康司(医学系研究科 統合生理学)
キーワード
イオンチャネル/膜電位/電気生理学/膜電位化学連関/非天然アミノ酸
応用分野
医療・ヘルスケア/生物物理化学
参考URL
https://resou.osaka-u.ac.jp/ja/research/2022/20220623_1
https://www.med.osaka-u.ac.jp/pub/phys2/okamura/
https://researchmap.jp/zdl134skhf
https://researchmap.jp/yasushiokamura
