研究 (Research)
最終更新日:
腸内細菌によるクローン病増悪メカニズムの解明と治療への応用 (Development of therapeutic strategy for Crohn’s disease by targeting microbiota-derived metabolites)
准教授 香山 尚子(高等共創研究院)、教授 竹田 潔(医学系研究科 免疫制御学) KAYAMA Hisako (Institute for Advanced Co-Creation Studies) , TAKEDA Kiyoshi (Graduate School of Medicine)
研究の概要
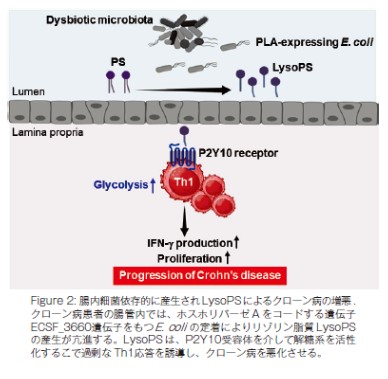
大腸や小腸などに慢性の炎症や潰瘍が生じる難治性疾患である炎症性腸疾患(潰瘍性大腸炎、クローン病など)では、「腸内細菌叢の乱れ」「腸内細菌が産生する代謝産物の種類や量の変化」が発症および病態形成に深く関与すると考えられている。しかし、細菌由来の代謝産物が宿主細胞におよぼす影響とその分子メカニズムについては不明な点が多い。本研究グループは、クローン病患者では、腸内細菌叢の乱れを起因として腸管内でリゾホスファチジルセリン(LysoPS)が増加すること、LysoPS が P2Y10受容体を介して Th1細胞を活性化することで大腸炎を重症化させることを見出した。LysoPS-P2Y10受容体シグナル経路により Th1細胞では解糖系の活性化が起こり、それに伴い、細胞増殖および IFN- γ産生の亢進が誘導されることで大腸炎の重症化につながることを明らかにした。
研究の背景と結果
脂質解析技術の進展により、炎症性腸疾患患者では、腸内細菌叢の変化に加え、血漿や便で一部の脂質分子が増加することが明らかになったが、多くの脂質分子については、産生機構と宿主細胞への作用は明らかになっていない。
研究グループは、クローン病患者の便においてリゾリン脂質の一種である LysoPS が増加していることを見出した。健常者とクローン病患者の便を用いてメタゲノム解析を行った結果、ホスホリパーゼAをコードする遺伝子を持つE. coli が増えていることにより、クローン病患者の腸内で LysoPS の産生が亢進することを明らかにした。
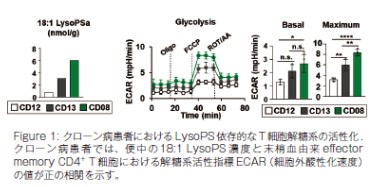
Rag2-/-マウスに野生型マウスの脾臓 naive CD4+T 細胞を移入してクローン病様大腸炎を発症させたマウスに LysoPS を腹腔内投与した結果、Th1細胞の増加を伴う大腸炎の重症化が起こることが示された。Th1細胞を LysoPS で刺激すると IFN- γの産生と細胞増殖が促進することが明らかとなった。さらに、網羅的な遺伝子発現解析を行った結果、Th1細胞では LysoPS 刺激により細胞内代謝経路の一つである解糖系にかかわる遺伝子の発現が亢進していることが示された。そこで、便中の LysoPS の濃度が低い・中程度・高いクローン病患者の末梢血中の CD4+T 細胞を用いて解糖系の活性化度合を示す ECAR(細胞外酸性化速度)の値を測定したところ、LysoPS 濃度に比例して ECAR の値が高くなることが明らかとなった。
LysoPS の受容体の一つである P2Y10受容体が Th1細胞に高発現することから、P2Y10受容体を持たない(P2y10-/y P2y10b-/y)マウスの脾臓 naive CD4+T 細胞もしくは野生型マウスの naive CD4+T 細胞を移入して大腸炎を発症させたRag2-/-マウスに LysoPS を腹腔内投与したところ、Th1細胞の増加および腸炎の重症化は起こらなかった。
研究の意義と将来展望
多因子疾患であり、未だ根本的治療法は確立されていないクローン病は、症状に合わせた多様な治療法の開発が望まれている。本研究成果により、クローン病の重症化につながる宿主免疫細胞(Th1細胞)内の代謝リプログラミング機構の一部が明らかとなり、LysoPS やP2Y10受容体シグナル経路を標的とした治療法および診断法の開発が加速することが期待される。
担当研究者
准教授 香山 尚子(高等共創研究院)、教授 竹田 潔(医学系研究科 免疫制御学)
キーワード
クローン病/P2Y10受容体/リゾホスファチジルセリン/Th1細胞/解糖系
応用分野
医療・ヘルスケア/創薬
参考URL
https://researchmap.jp/0425Kayama_Hisako
https://researchmap.jp/read0118278
