研究 (Research)
最終更新日:
ヒト多能性幹細胞を用いた涙腺オルガノイドの作製 (Generation of 3D lacrimal gland organoids from human pluripotent stem cells )
招へい教授 林 竜平(医学系研究科 幹細胞応用医学寄附講座) HAYASHI Ryuhei (Graduate School of Medicine)
研究の概要
眼球の表面(眼表面)は角膜と結膜からなり、眼表面の恒常性維持には涙液層の存在が必須です。涙液層は主に涙腺からの涙液やムチン分泌により維持されていますが、シェーグレン症候群などの自己免疫疾患により涙腺が障害されると、眼表面が乾燥し、重篤なドライアイとなります。これまでに我々の研究グループは、ヒト iPS 細胞から角膜や結膜を作製することに成功していましたが、涙腺の作製はいまだに報告がありませんでした。同研究グループは、角膜、結膜、涙腺は同じ発生起源であることに着目し、以前に角膜、結膜の誘導に用いた2次元の眼オルガノイド(SEAM と命名)を応用し、新たに涙腺原基の分化誘導を試みました。
まず SEAM 法により誘導した2次元眼オルガノイド内に涙腺様細胞クラスターが出現することを見出し、さらにセルソーターを用いて iPS 細胞由来涙腺前駆細胞を単離し、基底膜細胞外基質を豊富に含むマトリゲル内で3次元培養を行うことで、3次元の涙腺オルガノイドの作製に成功しました(図1)。
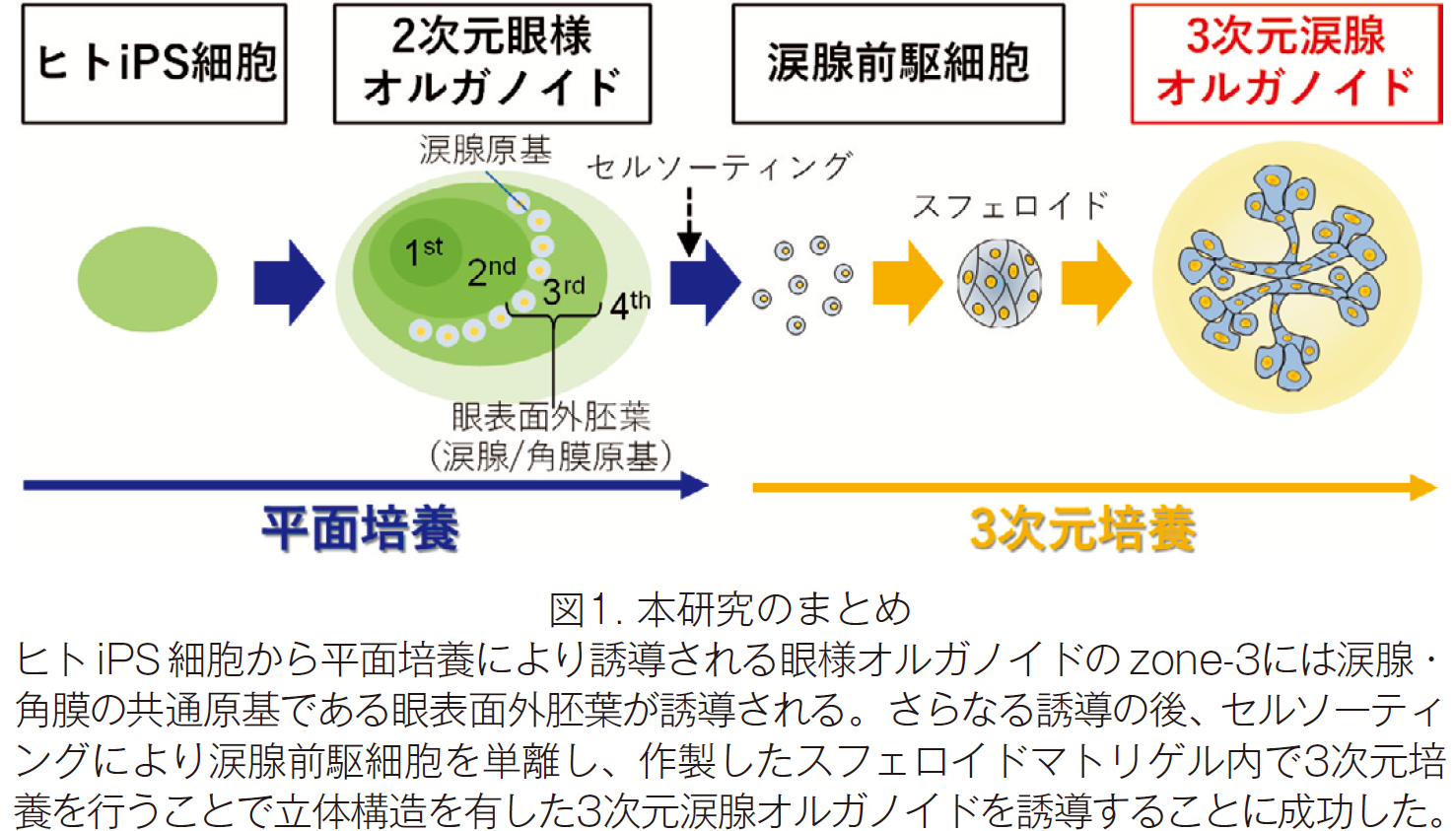
研究の背景と結果
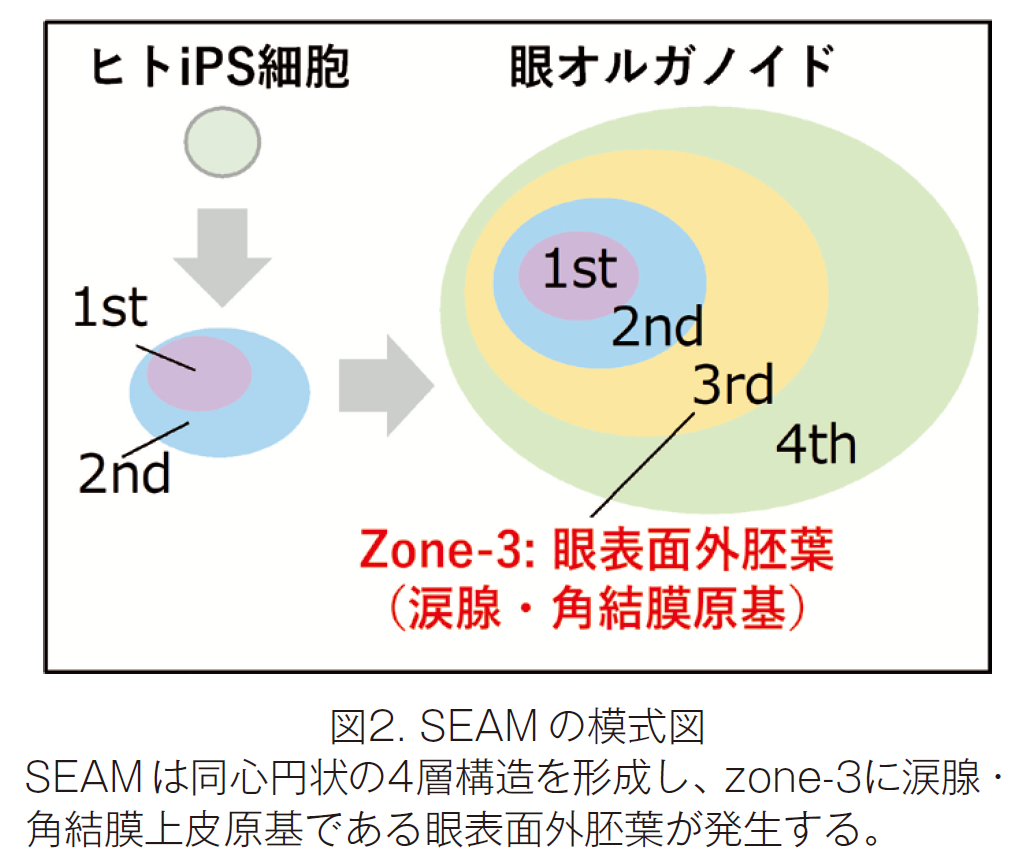
眼の表面は涙液層により保護され、その光学的機能や防御機能を維持しています。シェーグレン症候群などの疾患では涙腺機能障害により重症ドライアイが生じることで、眼表面の恒常性が破綻し、結果として視機能異常等が引き起こされます。しかしながら、涙腺は大人の体では再生しないため、根治的治療法が存在しないのが現状でした。これまでに研究グループは、ヒト iPS 細胞を用いて様々な眼の細胞を含む眼オルガノイドである多帯状コロニー(Self-formed Ectoderm Autonomous Multi-zone; SEAM)の誘導法を確立し(図2)、SEAMおよびその改変法により角膜上皮や結膜上皮組織の作製に成功していましたが(Hayashi R. et al. Nature 2016, Nomi K. et al. Cell Rep.2021など)、ヒト多能性幹細胞からの涙腺の誘導はこれまで報告されていませんでした。
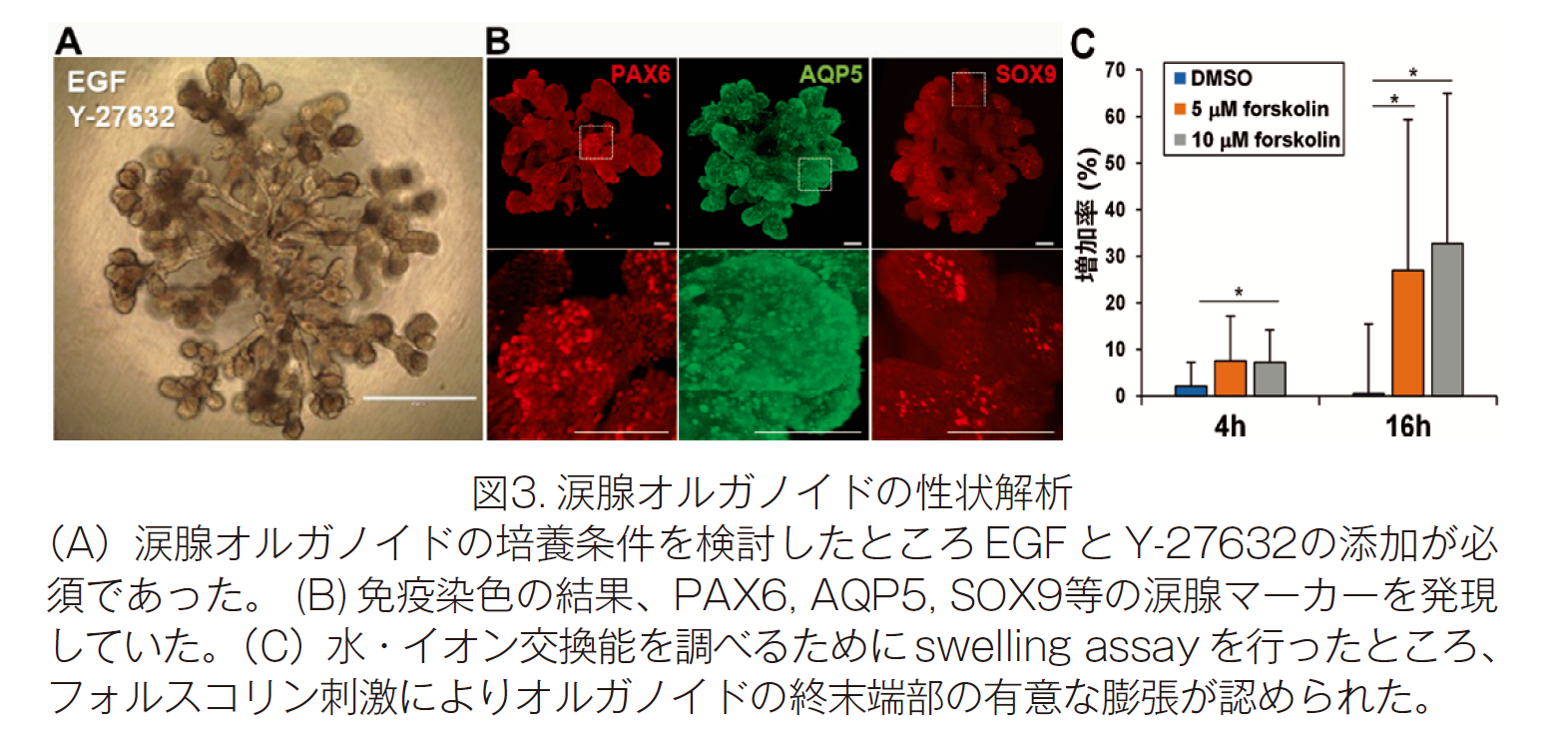
研究グループは誘導した SEAM 内の眼表面外胚葉(涙腺・角膜の共通発生原基)の領域(zone-3)において、PAX6/SOX9陽性の腺様構造を有する細胞クラスターが広く点在していることを見出しました。この腺様細胞クラスターを単離し、マトリゲル中で3次元培養を行ったところ、導管の出芽(budding)および伸長が認められ、さらに分岐(branching)が生じ、涙腺様の構造を呈しました。さらに、セルソーターによる涙腺前駆細胞の単離にも成功しました。作製した涙腺様オルガノイドの免疫染色を行ったところ、PAX6, AQP5, SOX9などの涙腺マーカーの発現を確認しました。また涙腺オルガノイド涙液分泌能を検証するために swelling assay を行ったところ、フォルスコリン刺激によりオルガノイドの終末端部の有意な膨張が認められました(図3)。
次に、得られた涙腺オルガノイドの生体内における生着と機能的な成熟を調べるために、免疫不全ラット(ヌードラット)への移植実験を行いました。移植後の涙腺オルガノイドを摘出し調べたところ、in vitroでは不十分であった導管形成や細胞極性がより明確となり涙腺組織としての成熟化が認められました。さらには、in vitro では殆ど発現が認められなかった涙液の防御タンパク質であるラクトフェリンやリゾチームの発現が移植後においては認められ、有意に増加しました。以上の結果より、ヒト iPS 細胞由来涙腺オルガノイドは移植後生体内に生着し、生体環境においてその機能がより成熟することが示されました。
研究の意義と将来展望
本研究成果により、これまで再生が不可能であった立体的な涙腺組織をヒト iPS 細胞から作製することが可能となり、重症ドライアイに対する根治的再生治療法の開発が可能となりました。また、入手困難なヒト涙腺組織を iPS 細胞から大量に作製できることで、ドライアイなどに対する創薬研究や病態解明研究において大きな進捗が期待されます。
担当研究者
招へい教授 林 竜平(医学系研究科 幹細胞応用医学寄附講座)
キーワード
多能性幹細胞/涙腺/iPS細胞/眼表面/再生医療
応用分野
再生医療/創薬
