研究 (Research)
最終更新日:
多機能性タンパク質に対する分解誘導薬の創製 (Discovery of protein degraders targeting a multi-functional protein)
准教授 伊藤 幸裕(産業科学研究所 複合分子化学研究分野) ITOH Yukihiro (SANKEN (The Institute of Scientific and Industrial Research))
研究の概要
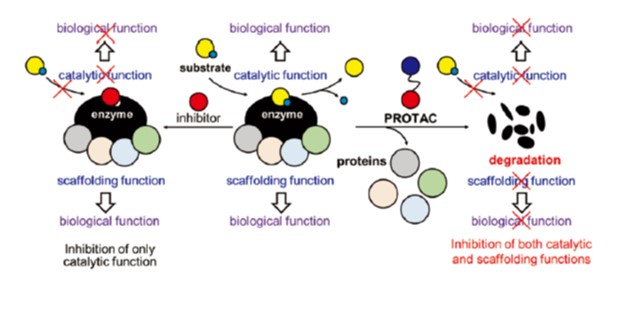
タンパク質分解誘導薬(PROTAC)は、生体内のタンパク質分解機構を利用して標的タンパク質を特異的に分解する分子であり、新たな創薬モダリティとして注目されている。PROTAC は、従来の創薬分子である酵素阻害薬や受容体アンタゴニストとは異なる性質を持つ。例えば、従来の創薬分子が標的タンパク質の特定の機能を抑制するのに対して、PROTAC は分解によって標的タンパク質の存在量を減少させるため、そのすべての機能を抑制することができる。
我々は、このような特性に興味を持ち、生体内で化学反応を触媒する酵素機能と他のタンパク質と相互作用する足場機能を持つタンパク質を標的とし、創薬を志向した PROTAC 研究を展開してきた。実際に、タンパク質脱アセチル化酵素 HDAC8などに対する PROTAC を見出すとともに、従来の阻害薬に対する PROTAC の優位性を示してきた。
研究の背景と結果
HDAC8はコヒーシンなどのタンパク質の脱アセチル化を触媒する酵素である。HDAC8はこのような酵素機能だけでなく、STAT3やCREB などの転写因子と相互作用する足場機能を有し、様々な遺伝子の発現を制御している。また、HDAC8は、成人 T 細胞白血病などをはじめ種々のがんの増殖に関与している。したがって、HDAC8の酵素機能と足場機能の両方を阻害する化合物は興味深い。そこで、我々はHDAC8に対する PROTAC の創製を試みた。
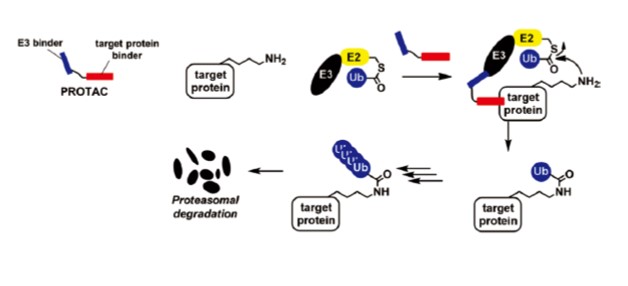
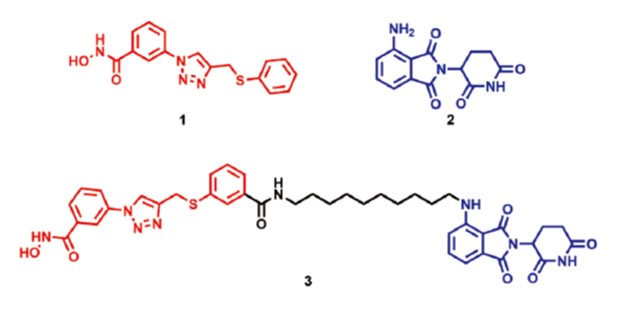
PROTAC は、標的タンパク質に結合する化合物にユビキチンリガーゼ(E3)に結合する化合物を連結させた分子であり、生体内のタンパク質分解機構であるユビキチンープロテアソームシステムを利用して、標的タンパク質のユビキチン化およびプロテアソーム分解を誘導する。我々は、HDAC8に結合し、HDAC8の酵素機能を阻害することができる化合物1と E3に結合するサリドマイド誘導体2を連結させた分子3を設計、合成し、その活性評価を行った。
合成した分子3を、ヒト T 細胞性白血病細胞 Jurkat に処理し、HDAC8に対する分解誘導活性を評価した結果、3は HDAC8量を濃度および時間依存的に減少させることがわかった。また、3によるHDAC8の減少は、プロテアソーム阻害薬によって阻害されたことから、3はユビキチン-プロテアソーム系依存的に HDAC8を分解することが確認された。さらに、Jurkat 細胞に対する増殖阻害活性を調べた。その結果、従来の HDAC8阻害薬である2に比べて、3は約9倍高い増殖抑制効果を示した(1: GI50 = 7.1μM、3: GI50 = 0.78 μM)。以上のように、我々は HDAC8 PROTAC の創製に成功するとともに、従来の阻害薬2に比べて、PROTAC 3は高い抗がん活性を示すことを明らかとした。
研究の意義と将来展望
PROTAC は様々なタンパク質に対して適応可能で、創薬の幅を広げる分子として注目されている。これまでに様々な疾患関連タンパク質に対するPROTAC が創製され、治療薬としての応用を志向した研究が展開されている。実際に、現在、十数種類のPROTAC ががんをはじめとする疾患に対する治療薬として臨床研究が行われている。近い将来、PROTAC が医薬品として承認されることも期待されている。
担当研究者
准教授 伊藤 幸裕(産業科学研究所 複合分子化学研究分野)
キーワード
標的タンパク質分解/PROTAC/HDAC8/酵素
応用分野
医療・ヘルスケア/創薬
