研究 (Research)
最終更新日:
リソソームによるNLRP3インフラマソーム活性制御のメカニズム解明 (Elucidating the mechanism of NLRP3 inflammasome activity regulation by lysosomes )
特任助教 辻本 考平、教授 熊ノ郷 淳(医学系研究科 呼吸器・免疫内科学) TSUJIMOTO Kohei , KUMANOGOH Atsushi (Graduate School of Medicine)
研究の概要
細胞内に細菌が侵入した際や何かしらの傷害が起きた際には、細胞はこれらの状況を “ 危険シグナル ” として感知し NLRP3インフラマソームと呼ばれる細胞内タンパク複合体を形成して免疫応答を開始します。NLRP3インフラマソームは感染症のみならず、癌や糖尿病・脂質異常症などの代謝異常、アルツハイマー型認知症などの神経変性疾患の病態形成にも重要な役割を果たしていることが近年明らかにされ、種々の疾患の新規の治療標的として期待が集まっています。しかし、創薬の分子学的基盤となるその詳細な活性制御機構はこれまで明らかではありませんでした。
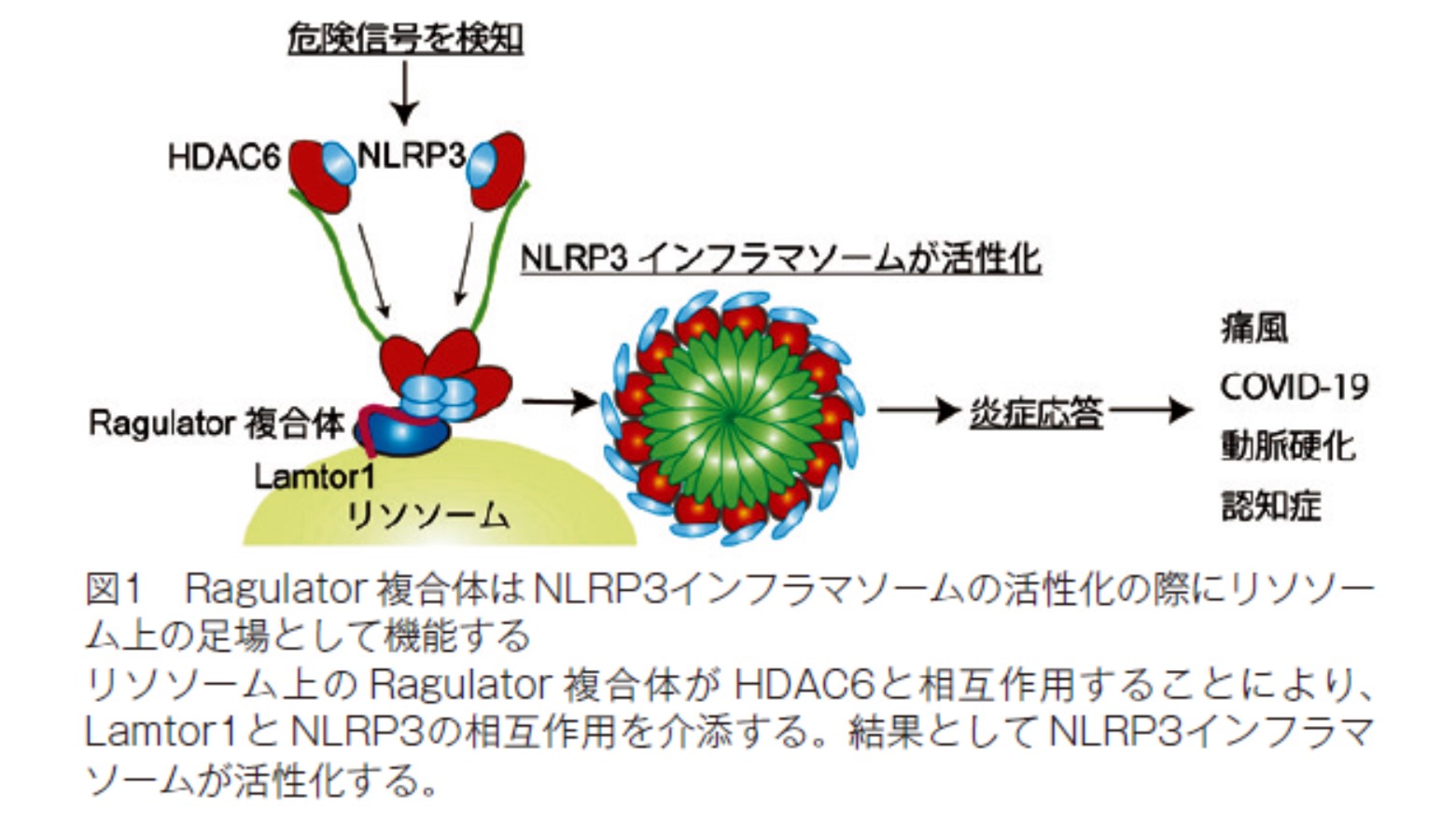
今回、我々の研究グループはリソソーム上に存在する Ragulator 複合体が HDAC6との相互作用を介して NLRP3インフラマソームの活性を制御している事を明らかにしました。
研究の背景と結果
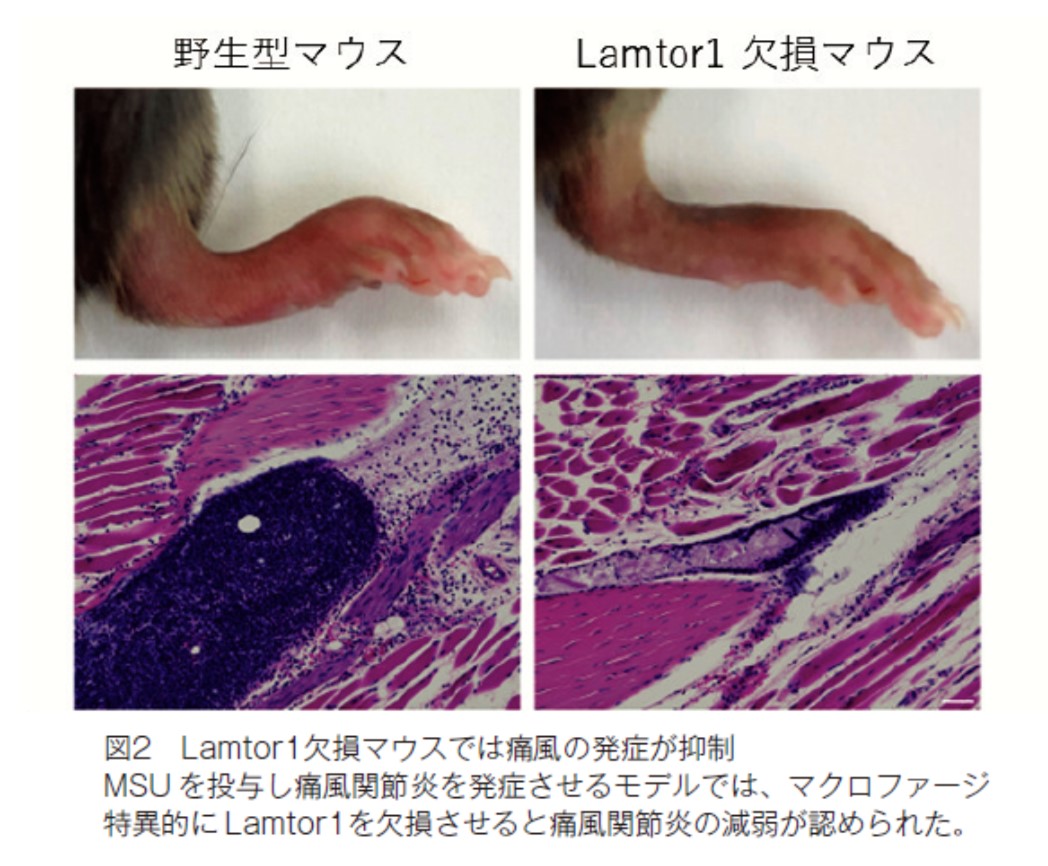
私たちの細胞は体内に侵入した病原体や尿酸などの結晶成分などの異物を「危険信号」として認識し “ インフラマソーム ” と呼ばれるタンパク複合体を活性化させます。その代表的な仕組みの一つであるNLRP3インフラマソームは各種の感染症やCOVID-19の重症化、痛風、動脈硬化症、アルツハイマー型認知症など様々な病気に関与していることが知られていますが、その活性化のメカニズムには不明な点が多く存在していました。私たちはマクロファージ特異的に Lamtor1(Ragulator 複合体の構成タンパクで、複合体の維持に必須であることが知られている)を欠損させたマウスを用いて、痛風を発症させるモデル実験を行うと Lamtor1欠損マウスではその炎症の度合いが著しく減弱することを見出しました。
マウスの骨髄由来マクロファージやヒト単球様細胞株を用いた培養細胞の実験では、Lamtor1を欠損させると NLRP3インフラマソームの活性化が阻害されることを見出しました。こうした現象の背景には、免疫沈降法や質量分析などの手法からLamtor1が NLRP3および HDAC6という二つのタンパク質にそれぞれ相互作用していることが判明しました。天然物ライブラリーを用いたスクリーニングにより、合成型ビタミン E である DL-all-rac-α-Tocopherol が Lamtor1と HDAC6の間の相互作用を阻害し、結果として NLRP3インフラマソームの活性を低下させることを見出しました。
また、合成型ビタミン E の投与によりマウスにおける痛風の炎症の度合 い が 低 下 す る こ と が 明 ら か と な り、生 体 レ ベ ル に お い て もRagulator 複合体による NLRP3インフラマソームの活性制御が治療標的となり得ることが示唆されました。
研究の意義と将来展望
我々の発見はリソソームが NLRP3インフラマソームの活性を制御するという、これまで知られていなかった新しい経路であり、本研究の知見をもとに新たな創薬標的の候補が明らかとなりました。
NLRP3インフラマソームは痛風やCOVID-19感染症、動脈硬化症、アルツハイマー型認知症など様々な疾患に重要な役割を果たしているため、これらの種々の疾患の新規治療の開発につながる可能性があります。
担当研究者
特任助教 辻本 考平、教授 熊ノ郷 淳(医学系研究科 呼吸器・免疫内科学)
キーワード
炎症/リソソーム/痛風/インフラマソーム/トコフェロール
応用分野
医療・ヘルスケア/創薬
参考URL
http://www.imed3.med.osaka-u.ac.jp/
https://researchmap.jp/Kohei_Tsujimoto
https://researchmap.jp/read0051725
